Gônadas
Os tecidos endócrinos do sistema genital estão restritos primordialmente às gônadas masculina (testículos) e feminina (ovários). Para sua abordagem detalhada, incluindo a anatomia dos órgãos genitais, gametogênese e regulação endócrina, consulte Sistema Reprodutor.
Testículos
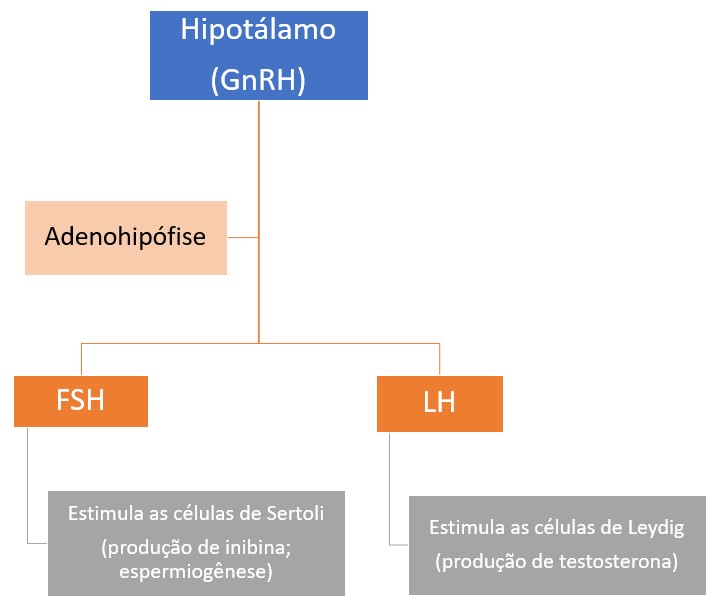
As funções dos testículos dependem da secreção de FSH (hormônio folículo estimulante) e LH (hormônio luteinizante) pela adenohipófise, ambos secretados em resposta à liberação de GnRH (hormônio liberador de gonadotrofina) pelo hipotálamo.
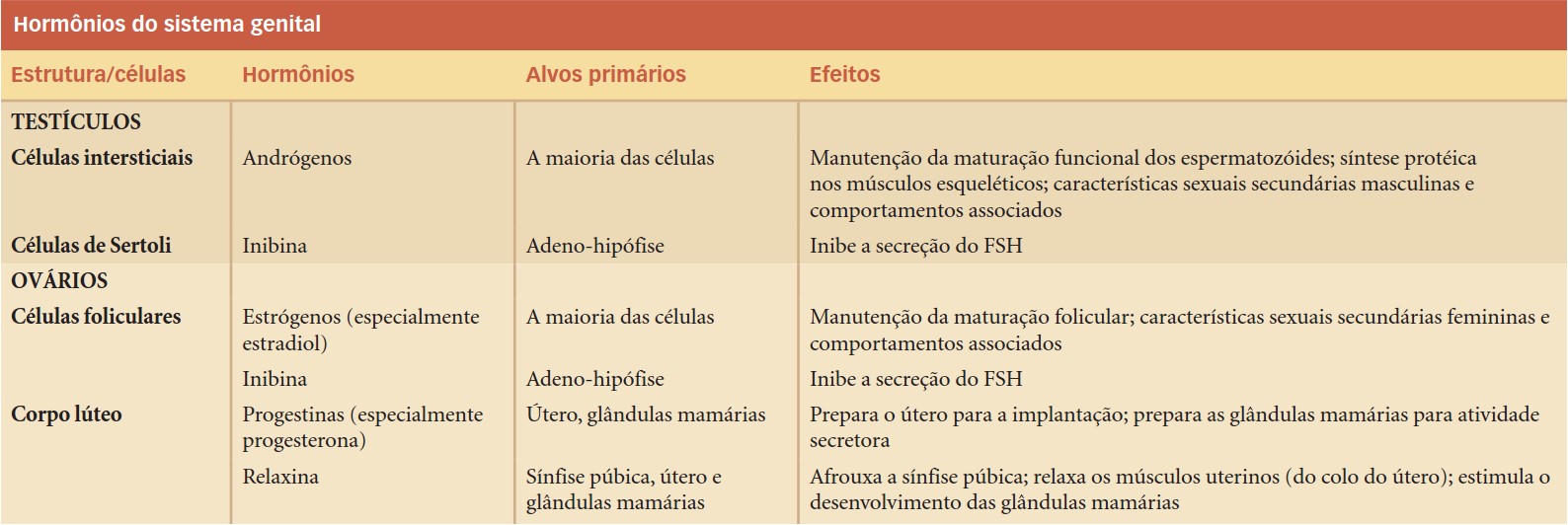
O principal hormônio secretado pelos testículos (células intersticiais ou células de Leydig) é a testosterona, um androgênio. Este hormônio promove a produção de espermatozoides funcionais, mantém as glândulas secretoras do sistema genital masculino, desenvolve e mantém os órgãos reprodutores masculinos, influencia as características sexuais secundárias e estimula o crescimento muscular.
Os testículos (células de Sertoli ou de sustentação) também secretam outro hormônio chamado inibina, cuja função é inibir a secreção de FSH pela adenohipófise (feedback negativo). Ao longo da vida, esses dois hormônios interagem para manter a produção de espermatozoides em níveis normais.
Ovários
Como os testículos, as funções ovarianas dependem da secreção da FSH e LH pela adenohipófise, ambos secretados em resposta à liberação de GnRH pelo hipotálamo.
Os principais hormônios secretados pelos ovários são os estrogênios (estrógenos) e a progesterona. Esses hormônios, juntamente com a FSH e LH, controlam o ciclo reprodutor feminino (ciclo menstrual), preparam as glândulas mamárias para a lactação e são responsáveis pela manutenção da gravidez. Os estrogênios e a progesterona também são responsáveis pelo desenvolvimento dos órgãos reprodutores femininos e pelas características sexuais secundárias.
Os ovários também secretam inibina, a qual inibe a secreção da FSH.

Nos ovários, os ovócitos iniciam sua maturação para se tornar gametas femininos no interior de estruturas especializadas denominadas folículos ovarianos. O processo de maturação é iniciado em resposta ao estímulo pelo FSH. As células foliculares que circundam o ovócito produzem estrógenos, especialmente o estradiol. Este hormônio esteroide sustenta a maturação dos ovócitos e estimula o crescimento do revestimento uterino; também estimula a liberação de LH pela adenohipófise (feedback positivo). Sob o estímulo do FSH, os folículos ativos secretam inibina, que suprime a liberação do FSH (feedback negativo). O LH estimula a ovulação.
Após a ovulação, as células foliculares remanescentes se reorganizam no corpo lúteo, que libera uma mistura de estrógenos e progestinas, especialmente a progesterona. A progesterona acelera o movimento do ovócito ao longo da tuba uterina e prepara o útero para a chegada do embrião em desenvolvimento. A progesterona também exerce feedback negativo nos hormônios do hipotálamo e da hipófise, inibindo a produção de GnRH, LH e FSH.
Durante a gravidez, os ovários e a placenta secretam estrogênios e progesterona, essenciais para a manter. Além disso, segregam relaxina, que aumenta a flexibilidade da sínfise púbica e ajuda a dilatar o colo do útero. Isto facilita o nascimento, alargando o canal de parto.
Pâncreas endócrino
Os tecidos endócrinos do pâncreas estão restritos às ilhotas pancreáticas. Para a abordagem detalhada deste órgão, incluindo a anatomia e a fisiologia na digestão, consulte-o em Sistema digestório.
O pâncreas endócrino consiste em pequenos grupos de células esparsas, sendo que cada grupo é circundado por células exócrinas. Os grupos, conhecidos como ilhotas pancreáticas, ou ilhotas de Langerhans, correspondem a apenas 1% da população das células pancreáticas.
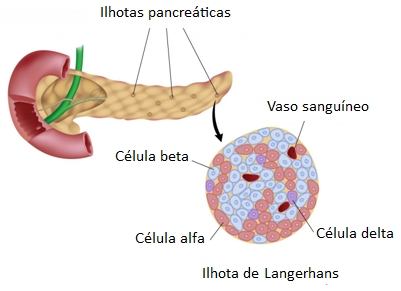
As ilhotas individuais se encontram espalhadas por todo o pâncreas, mas há uma pequena tendência de serem mais abundantes na região da cauda do que em outras partes do pâncreas, existindo cerca de 1 milhão de ilhotas no pâncreas normal. Como outros tecidos endócrinos, as ilhotas são circundadas por extensas redes de capilares sanguíneos fenestrados que transportam seus hormônios para a circulação.
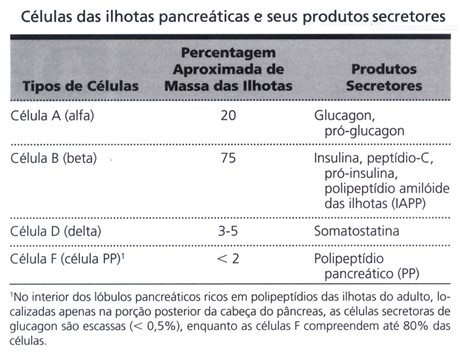
Tipos de células das Ilhotas pancreáticas
Cada ilhota pancreática contém quatro tipos de células produtoras de hormônios:
- células A ou alfa (α): constituem aproximadamente 17% das células da ilhota pancreática e secretam glucagon.
- células B ou beta (β): constituem aproximadamente 70% das células da ilhota pancreática e secretam insulina e amilina, hormônio que, com frequência, é secretado em paralelo com a insulina, apesar de sua função ainda não estar bem esclarecida.
- células D ou delta (δ): constituem cerca de 7% das células da ilhota pancreática e secretam somatostatina (idêntica ao hormônio inibidor do hormônio do crescimento, secretado pelo hipotálamo).
- células F ou PP: constituem o restante das células da ilhota pancreática e secretam polipeptídeo pancreático (PP).
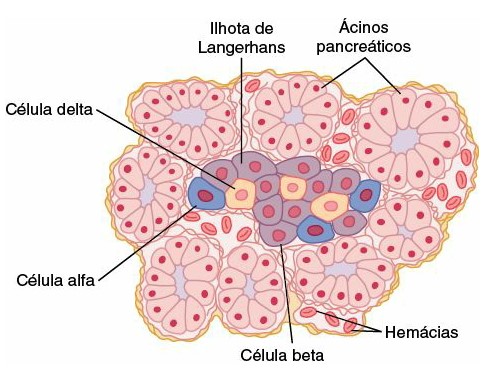
As interações estreitas entre esses tipos celulares possibilitam a comunicação intercelular (entre as células) e o controle direto da secreção de alguns dos hormônios. Por exemplo, o glucagon eleva a concentração sanguínea de glicose e a insulina a reduz. A insulina inibe a secreção de glucagon e a amilina inibe a secreção de insulina. A somatostatina inibe a liberação tanto de insulina quanto de glucagon, além de também atuar como hormônio circulante para reduzir a absorção de nutrientes pelo trato gastrointestinal. O polipeptídeo pancreático inibe a secreção de somatostatina, a contração da vesícula biliar e a secreção de enzimas digestivas pelo pâncreas.

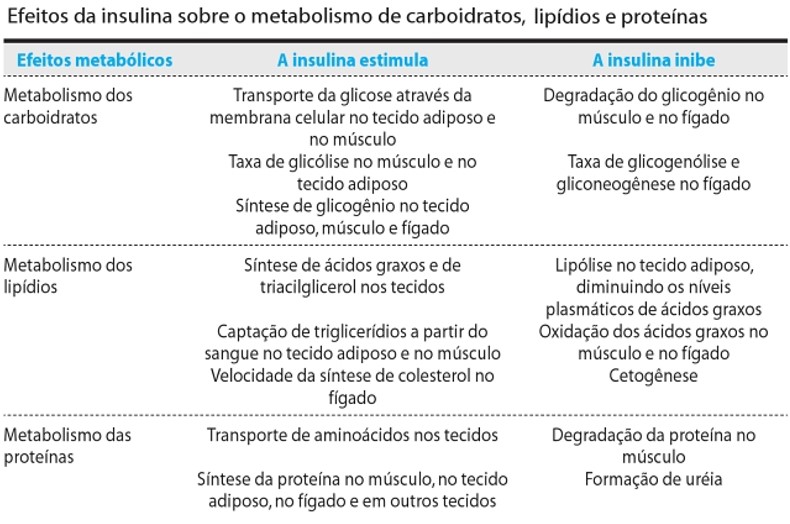
Ações fisiológicas da insulina
A insulina atua sobre diversas células do corpo para diminuir os níveis sanguíneos de glicose (glicemia), aumentando sua a captação e utilização pelas células. Influencia também o metabolismo das proteínas e das gorduras, principalmente nos músculos e tecido adiposo. Suas principais ações fisiológicas são:
- aumenta a captação da glicose (por difusão facilitada através de transportadores denominados GLUT) e sua utilização pela maioria das células do organismo (ela não acelera a entrada de glicose nos tecidos hepático, renal e encefálico, pois eles possuem livre acesso à glicose sanguínea, independentemente dos níveis de insulina);
- estimula a síntese de glicogênio a partir da glicose (glicogênese) e diminui a quebra do glicogênio em glicose (glicogenólise) pelo fígado e músculos;
- diminui a formação de glicose a partir do ácido lático e aminoácidos (gliconeogênese) pelo fígado;
- aumenta a captação de aminoácidos e intensifica a síntese de proteínas nos tecidos, principalmente nas células musculares;
- estimula a síntese de ácidos graxos (lipogênese) e triglicerídeos (triacilgliceróis) pelo fígado e tecido adiposo;
- inibe a lipólise (quebra dos triglicerídeos em moléculas de ácidos graxos e glicerol) e a cetogênese (quebra de ácidos graxos, produzindo corpos cetônicos) no tecido adiposo.
Transportadores de glicose (GLUT)
A glicose, principal fonte de energia celular, é transportada na maioria das células (captada) por difusão facilitada, através de proteínas transportadoras presentes na membrana plasmática. Essas proteínas, denominadas GLUT (do inglês, glucose transporter), pertencem a uma família de proteínas transmembranares que facilitam o transporte de glicose através da membrana plasmática por um processo conhecido como difusão facilitada.
Existem treze GLUTs identificados, dos quais os mais importantes são: GLUT-1, GLUT-2, GLUT-3 e GLUT-4.
| Transportador | Tecidos | Função |
| GLUT-1 | Todos os tecidos, particularmente hemácias e células endoteliais dos vasos sanguíneos do cérebro | Captação basal de glicose; transporte através da barreira hematoencefálica |
| GLUT-2 | Células do pâncreas, fígado, rins e intestinos | Funciona como sensor de glicose: regulação da liberação de insulina; outros aspectos da homeostasia da glicose |
| GLUT-3 | Neurônios e placenta | Juntamente com o GLT-1 é essencial para a glicose atravessa a barreira hematoencefálica |
| GLUT-4 | Músculo estriado e tecido adiposo | Principal transportador responsivo à insulina |
| GLUT-5 | Intestino delgado, rins e espermatozoides | Predominantemente um transportador de frutose |
Para maiores informações sobre transportadores de glicose (GLUT), consulte:
- MACHADO, U.F. Transportadores de Glicose. Arq Bras Endocrinol Metab 1998; 42(6): 413-421.
Ações fisiológicas do glucagon
O glucagon atua nos hepatócitos (células do fígado), acelerando a conversão do glicogênio em glicose (glicogenólise) e promovendo a formação de glicose a partir do ácido lático e de certos aminoácidos (gliconeogênese). Como resultado, os hepatócitos liberam glicose para o sangue com maior rapidez, e a concentração sanguínea de glicose aumenta, realizando, assim, a importante função de corrigir a hipoglicemia.
Outro efeito importante do glucagon é que ele ativa a lipase das células adiposas, disponibilizando quantidades aumentadas de ácidos graxos para os sistemas de energia do organismo. O glucagon também inibe o armazenamento de triglicerídeos no fígado, o que impede esse órgão de remover os ácidos graxos do sangue. Isto também ajuda na disponibilização de quantidades adicionais de ácidos graxos para outros tecidos do organismo usarem como fonte de energia.
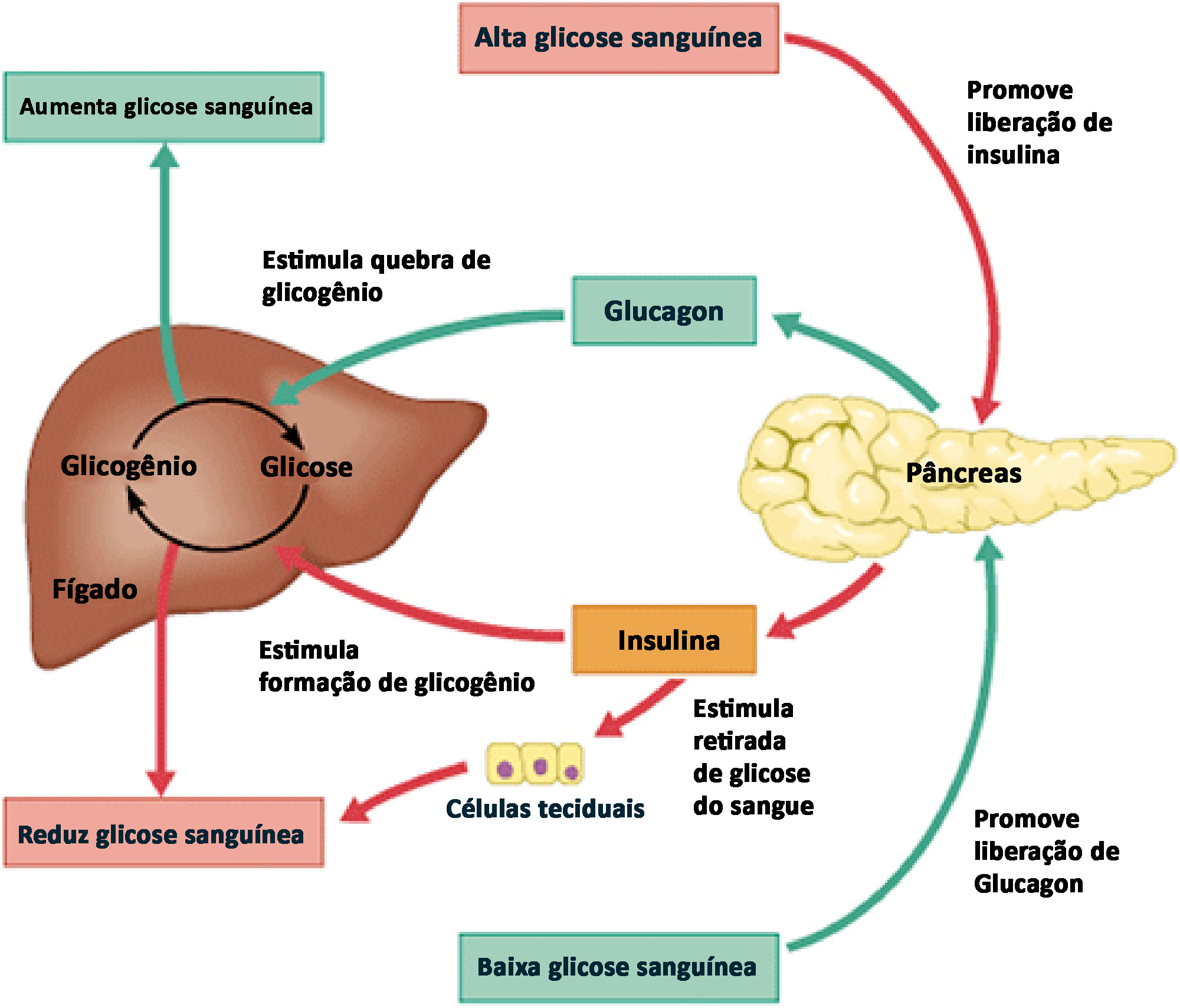
Regulação da glicose sanguínea (glicemia) pela insulina e glucagon
O principal efeito da insulina é o de reduzir a concentração sanguínea de glicose (glicemia) quando seu nível está muito elevado (hiperglicemia), sendo mais evidente logo após as refeições. Desta forma, a alta concentração sanguínea de glicose (hiperglicemia) estimula a liberação de insulina pelas células beta (β) das ilhotas pancreáticas. Se a concentração sanguínea de glicose cair abaixo do normal, a baixa glicemia (hipoglicemia) inibe a liberação de insulina.
Por outro lado, a principal ação do glucagon é a de aumentar a glicemia, quando seu nível cai abaixo do normal (hipoglicemia). Portanto, a baixa concentração sanguínea de glicose (hipoglicemia) estimula a liberação de glucagon pelas células alfa (α) das ilhotas pancreáticas. Se a concentração sanguínea de glicose aumenta, a alta glicemia (hiperglicemia) inibe a liberação de glucagon pelas células alfa das ilhotas pancreáticas.
Assim, a concentração sanguínea de glicose controla a secreção de insulina e de glucagon, por meio de sistemas de retroalimentação negativa (feedback negativo).
Desequilíbrio na regulação da glicemia

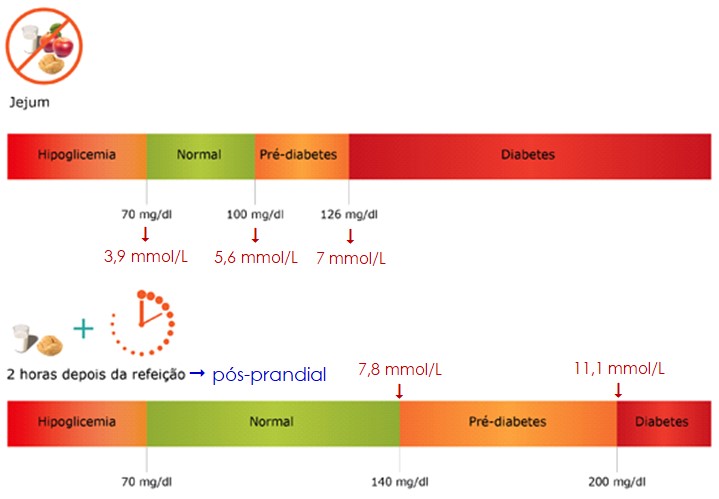
Numa pessoa normal, a glicemia está sob controle estrito, geralmente entre 70 e 90 mg/100 mL (ou mg/dL) de sangue na pessoa em jejum. Essa concentração aumenta para 120 a 140 mg/dL durante a primeira hora ou um pouco mais depois da refeição (glicemia pós-prandial), mas os sistemas de feedback para o controle da glicemia restabelecem a concentração de glicose rapidamente de volta aos níveis de controle, em geral, dentro de 2 horas depois da última absorção de carboidratos.
Inversamente, na ausência de alimentação (e sob o efeito do glucagon), as funções de glicogenólise e gliconeogênese do fígado produzem a glicose necessária para manter o nível sérico de glicose em jejum.
Entretanto, se a glicemia baixar dos 70 mg/dL, institui-se um quadro de hipoglicemia, o qual, em indivíduos normais, provoca sinais de hiperatividade autônoma, tanto simpáticos (taquicardia, palpitações, sudorese, tremor, cefaleia) quanto parassimpáticos (náusea, fome, sonolência).

A hipoglicemia pode ter várias causas:
- uso inadequado de insulina (dose de insulina grande para as necessidades imediatas);
- uso inadequado de medicamentos hipoglicemiantes orais;
- jejum prolongado ou inanição;
- consumo inadequado de carboidratos;
- consumo exagerado de bebidas alcoólicas;
- exercício físico exagerado ou por tempo prolongado além do recomendado sem os cuidados necessários.
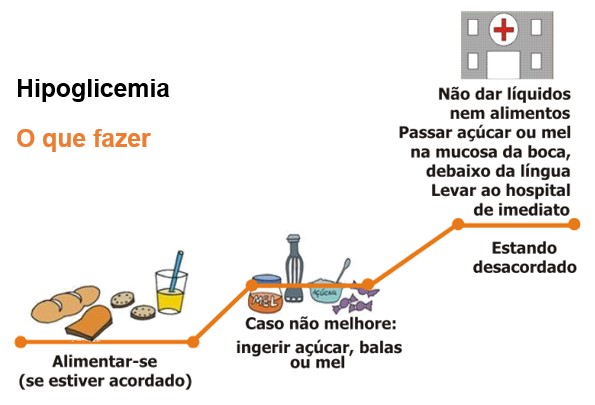
Caso a glicemia diminua para 40 mg/dL (condição hipoglicêmica grave), geralmente associada ao uso de insulina por diabéticos ou ao consumo exagerado de bebidas alcoólicas associado a jejum prolongado ou inanição (no caso de dietas restritivas, principalmente), a pessoa sente desconforto e confusão mental. Reduções adicionais levam à letargia, convulsões e coma e, em casos de hipoglicemia extrema, à morte, se o individuo não receber assistência imediata.
OBS.:
Em indivíduos diabéticos expostos a frequentes episódios hipoglicêmicos durante o controle rigoroso da glicemia com insulina, os sinais autônomos de alerta da hipoglicemia são menos frequentes ou até mesmo ausentes. Essa perigosa condição adquirida é denominada “inconsciência hipoglicêmica”. Quando o paciente carece dos sinais de alerta precoces de baixos níveis de glicemia, pode não tomar as medidas corretivas no momento necessário. Em pacientes com hipoglicemia não tratada e persistente, podem surgir as manifestações de excesso de insulina – confusão, fraqueza e comportamento bizarro, convulsões e coma, quando podem não ser mais capazes de procurar ou consumir com segurança alimentos que contenham glicose.
Para maiores informações sobre hipoglicemia e diabetes, consulte:
- NERY, M. Hipoglicemia como Fator Complicador no Tratamento do Diabetes Melito Tipo 1. Arq Bras Endrocrinol Metab 2008; 52(2): 288-298.
Veja também:
- Entenda a relação entre diabetes e hipoglicemia após o exercício.
Por outro lado, nas pessoas com tolerância normal à glicose, os níveis de glicemia pós-prandial (aumento da glicemia após a refeição) raramente sobem acima de 140 mg/dL (7,8 mmol/L) e, tipicamente, retornam aos seus valores basais 2 a 3 horas após a ingestão alimentar.
A Organização Mundial de Saúde (OMS) define tolerância normal à glicose como uma glicemia <140 mg/dL (< 7,8 mmol/L) duas horas após a ingestão de uma sobrecarga de 75 g de glicose no contexto de uma prova de tolerância à glicose oral (PTGO). Nestas recomendações define-se hiperglicemia pós-prandial como um nível plasmático de glicose >140 mg/dL (>7,8 mmol/L) duas horas após a ingestão de alimentos.
A hiperglicemia pós-prandial pode indicar declínio progressivo da ação e da secreção de insulina antes da manifestação do diabetes mellitus (diabetes melito) clínico por:
- perda da primeira fase da secreção da insulina;
- sensibilidade diminuída à insulina nos tecidos periféricos;
- supressão diminuída do débito hepático de glicose após as refeições devido à deficiência de insulina.

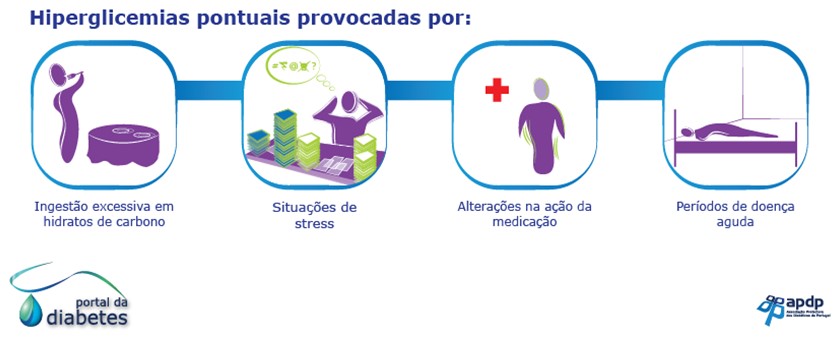
As hiperglicemias ocasionais podem ser provocadas por:
- ingestão excessiva de carboidratos;
- situações de estresse;
- alterações na ação da medicação, na absorção intestinal dos medicamentos ou problemas técnicos na administração de insulina (diabéticos);
- períodos de doença aguda (diabéticos), infecções urinárias, respiratórias, intestinais.
OBS.:
O desenvolvimento de diabetes melito tipo 2 (DM2) é caracterizado por um declínio progressivo da ação da insulina e uma deterioração da função das células e, em consequência, da secreção de insulina. Antes do diabetes clínico, estas anomalias metabólicas tornam-se inicialmente evidentes através de subidas da glicose plasmática pós-prandial, devido à perda da primeira fase da secreção da insulina, sensibilidade diminuída à insulina nos tecidos periféricos e consequente supressão diminuída do débito hepático de glicose após as refeições devido à deficiência de insulina.
Sintomas da hiperglicemia
Quando a glicemia está muito elevada, podem existir sintomas com:
- urinar em grande quantidade e mais vezes (poliúria)
- sede constante e intensa (polidpsia)
- sensação de boca seca
- fome constante e difícil de saciar
- cansaço
- comichão no corpo (sobretudo ao nível dos órgãos genitais)
- visão turva
Diabetes melito (DM)
O diabetes melito (ou diabetes mellitus) é um grupo de doenças metabólicas caracterizadas por hiperglicemia e associadas a complicações, disfunções e insuficiência de vários órgãos, especialmente olhos, rins, nervos, cérebro, coração e vasos sanguíneos. Pode resultar de defeitos de secreção e/ou ação da insulina envolvendo processos patogênicos específicos, por exemplo, destruição das células beta do pâncreas (produtoras de insulina), resistência à ação da insulina, distúrbios da secreção da insulina, entre outros.
(MINISTÉRIO DA SAÚDE. Diabetes mellitus. Cadernos de Atenção Básica n.º 16, 2006.)
A hiperglicemia crônica e suas anormalidades metabólicas associadas causam as muitas complicações do diabetes, as quais, tradicionalmente, são categorizadas como distúrbios microvasculares e macrovasculares que resultam em retinopatia, nefropatia, neuropatia, doença coronariana, doença cerebrovascular e doença arterial periférica. O diabetes também tem sido responsabilizado por contribuir para agravos, direta ou indiretamente, no sistema musculoesquelético, no sistema digestório, na função cognitiva e na saúde mental, além de ser associado a diversos tipos de câncer.
Quando a insulina está ausente ou deficiente, os níveis sanguíneos de glicose permanecem altos após uma refeição, e a glicose é incapaz de entrar na maioria das células dos tecidos. Geralmente, quando os níveis sanguíneos de glicose aumentam, os hormônios hiperglicêmicos não são liberados, mas quando a hiperglicemia se torna excessiva a pessoa começa a se sentir nauseada, o que desencadeia a reação de luta-ou-fuga. Isto resulta, inadequadamente, em todas as reações que normalmente ocorrem em um estado de hipoglicemia para disponibilizar glicose — isto é, glicogenólise, lipólise (degradação de lipídeos) e gliconeogênese. Assim, os níveis sanguíneos de glicose que já estavam altos ficam mais altos ainda, e o excesso de glicose começa a ser perdido do corpo pela urina (glicosúria).
Tipos de diabetes
Os tipos de diabetes mais frequentes são o diabetes melito tipo 1 (DM1), que compreende cerca de 10% do total de casos, e o diabetes melito tipo 2 (DM2), que compreende cerca de 90% do total de casos. Outro tipo de diabetes encontrado com maior frequência e cuja etiologia ainda não está completamente esclarecida é o diabetes melito gestacional (DMG), que, em geral, é um estágio pré-clínico de diabetes, detectado no rastreamento pré-natal. Outros tipos específicos de diabetes menos frequentes podem resultar de defeitos genéticos da função das células beta, defeitos genéticos da ação da insulina, doenças do pâncreas exócrino, endocrinopatias, efeito colateral de medicamentos, infecções e outras síndromes genéticas associadas ao diabetes.
| Tipos de diabetes |
DM1
|
| DM2 |
| DMG (diabetes melito gestacional) |
| Outros tipos específicos de diabetes |
O DM1 é caracterizado por hipoinsulinismo absoluto e é o resultante de uma destruição das células beta pancreáticas com consequente deficiência de insulina. Na maioria dos casos essa destruição das células beta é mediada por autoimunidade, porém existem casos em que não há evidências de processo autoimune, sendo, portanto, referida como forma idiopática do DM1 (minoria dos casos).
A taxa de destruição das células beta é variável, sendo em geral mais rápida entre as crianças. A forma lentamente progressiva ocorre geralmente em adultos e é referida como latent autoimmune diabetes in adults (LADA).
Os indivíduos com DM1 podem desenvolver cetoacidose e apresentam graus variáveis de deficiência de insulina. No DM1 o metabolismo modifica-se para um estado catabólico excessivo, exacerbando as reações típicas do estado de jejum. A gliconeogênese exacerba-se, bem como a lipólise e, consequentemente, a cetogênese. O resultado é a ocorrência de um distúrbio metabólico grave e potencialmente fatal, denominado cetoacidose diabética, caracterizado por hiperglicemia acentuada e acidose metabólica grave, devido ao acúmulo de corpos cetônicos em grande quantidade no plasma. O início geralmente é abrupto, com sintomas indicando de maneira sólida a presença da enfermidade.
O DM2 caracteriza-se por dois defeitos fisiopatológicos principais: a resistência à insulina, que resulta em aumento da produção hepática de glicose e redução da sua utilização periférica, e o comprometimento da função secretora da célula beta, ou seja, não há destruição das células β pancreáticas, porém ocorre uma hipossensibilidade dessas células à glicose, bem como uma resistência periférica à ação da insulina.
A evolução para o DM2 ocorre ao longo de um período de tempo variável, passando por estágios intermediários que recebem a denominação de glicemia de jejum alterada e tolerância à glicose diminuída. Tais estágios seriam decorrentes de uma combinação de resistência à ação insulínica e disfunção de células beta. O pico precoce pós-prandial de insulina costuma ser inibido (ou abolido) antes da fase sustentada. Neste caso, existe uma pequena ou moderada ação insulínica, porém, com predomínio do efeito dos hormônios contrarreguladores, especialmente o glucagon (hipoinsulinismo relativo).
No DM2 a gliconeogênese também é exacerbada e a captação de glicose periférica fica reduzida, efeitos que levam, respectivamente, à hiperglicemia de jejum e à hiperglicemia pós-prandial acentuada. Contudo, a lipólise e a cetogênese não estão significativamente ativadas nesses pacientes, salvo em raras condições de extremo estresse metabólico. Por isto, estes pacientes não são propensos à cetoacidose diabética. A descompensação metabólica grave mais característica do DM2 é a síndrome hiperosmolar não-cetótica, associada a altos níveis de glicemia (> 600 mg/dL). A maioria dos indivíduos apresenta obesidade, hipertensão arterial e dislipidemia, e há necessidade de intervenções abrangendo essas múltiplas anormalidades metabólicas.

A insulina constitui a intervenção farmacológica primária para o DM1, enquanto o DM2 geralmente pode ser tratado com diversos fármacos diferentes.
O diabetes melito gestacional (DMG) é definido como qualquer nível de intolerância à glicose, resultando em hiperglicemia de gravidade variável, com início ou diagnóstico durante a gestação. Na maioria dos casos há reversão para a tolerância normal após a gravidez, porém existe um risco de 17%-63% de desenvolvimento de DM2 dentro de 5-16 anos após o parto.
Animação: A relação entre o transporte através da membrana plasmática e o diabetes tipo 2
Para maiores informações sobre diabetes melito, consulte:
- MINISTÉRIO DA SAÚDE. Diabetes mellitus. Cadernos de Atenção Básica nº 16, 2006. Disponível em: <https://bvsms.saude.gov.br/bvs/publicacoes/diabetes_mellitus.PDF> Acesso em 08/07/2021.
- MINISTÉRIO DA SAÚDE - SECRETARIA DE ATENÇÃO À SAÚDE/DEPARTAMENTO DE ATENÇÃO BÁSICA. Estratégias para o cuidado da pessoa com doença crônica diabetes mellitus. Cadernos de Atenção Básica nº 36, 2013. Disponível em: <https://bvsms.saude.gov.br/bvs/publicacoes/estrategias_cuidado_pessoa_diabetes_mellitus_cab36.pdf> Acesso em 08/07/2021.
- SOCIEDADE BRASILEIRA DE DIABETES (SBD). Diretrizes SBD 2015-2016. Disponível em: <http://www.epi.uff.br/wp-content/uploads/2013/10/DIRETRIZES-SBD-2015-2016.pdf> Acesso em 08/07/2021.
- SOCIEDADE BRASILEIRA DE DIABETES (SBD). Diretrizes SBD 2019-2020. Disponível em: <https://www.diabetes.org.br/profissionais/images/DIRETRIZES-COMPLETA-2019-2020.pdf> Acesso em 08/07/2021.
- SOCIEDADE BRASILEIRA DE DIABETES (SBD). Tratamento e acompanhamento do Diabetes mellitus: Diretrizes SBD 2007. Disponível em: <https://www.cff.org.br/userfiles/file/noticias/Diretrizes_SBD_2007%5B1%5D.pdf> Acesso em 08/07/2021.
Veja também:
- Anemia e estresse estão entre causas de internação de diabéticos tipo 2.
- Comer muito doce causa diabetes? Veja mitos e verdades sobre a doença.
- Como diabetes sem controle pode causar impotência e cegueira.
- Covid-19 é quatro vezes mais fatal entre pacientes com diabetes.
- Diabetes é a variável que mais impacta número de mortes por infarto.
- Diabetes gestacional: como descobrir e tratar a doença.
- Diabetes tipo 2 pode acelerar envelhecimento do cérebro, diz estudo.
- Diabetes: você sabe quais problemas a doença pode causar?
- Entenda por que o pré-diabetes não é uma pré-doença.
- Pequena proteína reduz níveis de açúcar, gera patente e pode ser aliada no combate ao diabete.
- Por que pessoas com obesidade tendem a ter diabetes? Estudo explica.
- Resistência à insulina: como saber se você tem e por que é importante saber.
Timo
O timo é um órgão bilobado localizado atrás do osso esterno no tórax. Em recém-nascidos e crianças pequenas, o timo é relativamente grande, muitas vezes se estendendo desde a base do pescoço até a margem superior do coração, diminuindo de tamanho após a puberdade e com o passar dos anos da vida adulta. Para a abordagem detalhada deste órgão, incluindo a anatomia e seu papel na defesa imune, consulte-o em Sistema Linfático e Imune.
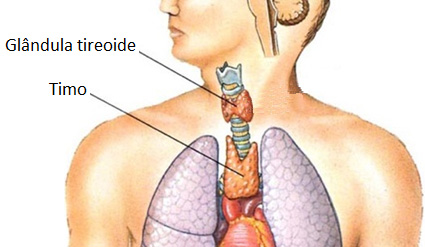
Como glândula endócrina, o timo produz vários hormônios importantes para o desenvolvimento e a manutenção das defesas imunológicas normais.
Os hormônios produzidos pelo timo — timosina, fator humoral do timo (THF), fator tímico (FT) e timopoetina — pertencem a uma família de hormônios peptídicos que promovem a maturação das linfócitos T, sendo essenciais para o desenvolvimento normal destas células e da resposta imunológica.
Glândula pineal
A glândula pineal, ou "epífise do cérebro", é um pequena glândula endócrina de coloração avermelhada e formato semelhante ao de uma pinha; faz parte do epitálamo, evaginação dorsal do tálamo no diencéfalo. Suas células secretoras, chamadas de pinealócitos, estão arranjadas em grupos e fileiras compactas. Os pinealócitos sintetizam a melatonina, um hormônio derivado da serotonina (neurotransmissor) que modula os padrões de sono/vigília nos ciclos circadianos e sazonais. A melatonina também é um potente antioxidante, que pode fornecer alguma proteção contra os radicais livres (espécies reativas de oxigênio).
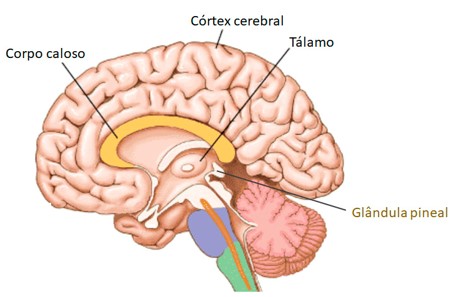
Além dos pinealócitos, a glândula pineal contém neurônios e células da glia. Fibras nervosas colaterais das vias visuais atingem a glândula pineal e interferem na velocidade de produção de melatonina, que aumenta à noite e diminui durante o dia. Este ciclo é aparentemente importante na regulação do ritmo circadiano, o ciclo natural de sono e vigília.
As concentrações de melatonina são mais elevadas em crianças e diminuem com o amadurecimento na idade adulta.
Veja também:
- A melatonina em tempos de ômicron e influenza H3N2.
- Uso de hormônio do sono requer cuidados.