Hormônios hipotalâmicos armazenados e secretados pela neurohipófise
Como previamente apresentado, o hormônio antidiurético (ADH) e a ocitocina são os dois hormônios hipotalâmicos armazenados e secretados pela hipófise posterior (neurohipófise), entrando diretamente na circulação sistêmica.
Hormônio antidiurético (ADH)
O hormônio antidiurético (ADH ou vasopressina) é sintetizado pelos neurônios do núcleo supraóptico hipotalâmico e é o principal agente fisiológico regulador do equilíbrio hídrico no corpo humano. A ação renal mais importante do ADH é a de aumentar a permeabilidade à água dos epitélios dos túbulos distal e coletor, deixando a urina mais concentrada. Desta forma, o ADH controla a excreção da água na urina, ajudando, assim, a controlar a quantidade da água nos líquidos corporais (ver Regulação endócrina da reabsorção tubular).
O ADH ainda induz vasoconstrição por meio da estimulação da secreção de endotelina. Os neurônios portadores de ADH também secretam ADH na circulação venosa portal. As moléculas de ADH e CRH (hormônio liberador de corticotropina) regulam a secreção de ACTH (hormônio adrenocorticotrópico ou corticotropina) pela adenohipófise.

A carência desse hormônio causa a doença diabetes insípido, na qual a pessoa apresenta grande aumento do fluxo urinário (poliúria) e inabilidade de concentrar a urina (hipostenúria), provocando muita sede (polidipsia), geralmente acompanhada de grande apetite e perda de força muscular.
Para maiores informações sobre diabetes insípido, consulte:
- PINHEIRO, P. Diabetes insipidus – causas, sinais e tratamento. Disponível em: <https://www.mdsaude.com/nefrologia/diabetes-insipidus/> Acesso em 30/06/2021.
Ocitocina
A ocitocina foi o primeiro hormônio a ter suas atividades biológicas estabelecidas e sua estrutura química determinada. É sintetizada pelos neurônios do núcleo paraventricular hipotalâmico, que enviam fibras nervosas para a hipófise posterior (neurohipófise), o local de armazenamento e liberação tanto de ocitocina quanto de ADH circulantes. Os neurônios produtores de ocitocina do núcleo paraventricular ainda se projetam para uma série de áreas centrais, incluindo partes do sistema límbico, diencéfalo, mesencéfalo, tronco encefálico e medula espinhal.

A ocitocina estimula as contrações uterinas durante o parto e a ejeção de leite durante a lactação. Em mães que amamentam, a sucção estimula as terminações nervosas nos mamilos, desencadeando a secreção de ocitocina (e prolactina) por meio de reflexos neuro-humorais.
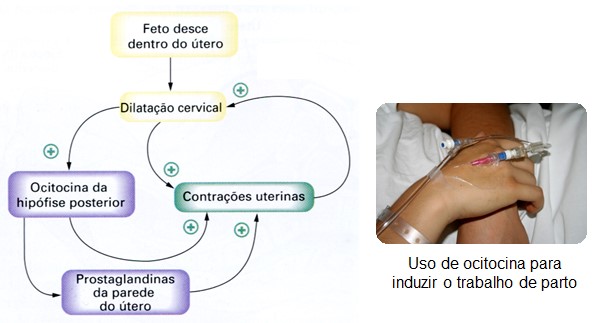
Entretanto, esses não são os únicos efeitos fisiológicos da ocitocina. A ocitocina é encontrada no cérebro feminino e masculino, circula em concentrações semelhantes no sangue de ambos os sexos e tem estímulos de liberação semelhantes para ambos os sexos, sugerindo também outras funções fisiológicas e um papel funcional nos homens.
De fato, a ocitocina é conhecida como hormônio do amor (ver Fisiologia da paixão), por promover laços sociais, aumentar a confiança e reduzir o estresse e a ansiedade em ambos os sexos. Nos homens, também está está envolvida (juntamente com outros mediadores centrais) no controle erétil, tendo um papel facilitador.
Além disso, estudos recentes indicam que a ocitocina está envolvida na cognição, tolerância, adaptação e comportamento sexual e materno complexos, bem como na regulação das funções cardiovasculares, induzindo natriurese (aumento da excreção urinária de sódio) e causando queda na pressão arterial média, tanto após tratamento agudo quanto crônico.
Para maiores informações sobre ocitocina, consulte:
- ANDERSSON, K.E. Mechanisms of penile erection and basis for pharmacological treatment of erectile dysfunction. Pharmacol Rev 2011; 63(4): 811-859.
- GUTKOWSKA, J.; JANKOWSKI, M.; MUKADDAM-DAHER, S.; MCCANN, S.M. Oxytocin is a cardiovascular hormone. Braz J Med Biol Res 2000; 33(6): 625-633.
- KOSFELD, M.; HEINRICHS, M.; ZAK, P.J.; FISCHBACHER, U.; FEHR, E. Oxytocin increases trust in humans. Nature 2005; 435: 673–676.
- NEUMANN, I.D.; TORNER, L.; WIGGER, A. Brain oxytocin: differential inhibition of neuroendocrine stress responses and anxiety-related behaviour in virgin, pregnant and lactating rats. Neuroscience. 2000; 95(2): 567-575.
- EBNER, N.C.; HORTA, M.; LIN, T.; FEIFEL, D.; FISCHER, H.; COHEN, R.A. Oxytocin modulates meta-mood as a function of age and sex. Front Aging Neurosci 2015; 7: 175.
- MCGREGOR, G.P.; LANG, R.E. Oxytocin in the male: an old hormone growing sexy with age. Exp Clin Endocrinol Diabetes 2001; 109(2): 83-86.
Hormônios da adenohipófise
A concentração plasmática de hormônios que estão sob a influência do hipotálamo e da glândula hipófise é sempre regulada. Os hormônios hipotalâmicos liberadores (liberinas) sintetizados no hipotálamo causam a liberação dos hormônios trópicos (trofinas) na adenohipófise. As trofinas, então, estimulam a liberação dos hormônios respectivos na periferia (glândulas-alvo). Os hormônios periféricos, por sua vez e, em alguma extensão, também seus efeitos sistêmicos, inibem a liberação de liberinas no hipotálamo e de trofinas na hipófise (retroalimentação negativa).
A liberação reduzida de hormônios periféricos pode ocorrer devido a uma perda de função do hipotálamo, da hipófise ou da glândula hormonal periférica. A causa primária da liberação aumentada de hormônios periféricos pode ser uma liberação inadequadamente alta ortotópica (no sítio anatômico normal de produção) ou ou ectópica (fora do sítio anatômico normal de produção) de liberinas, trofinas ou hormônios periféricos.
Se houver uma liberação aumentada de liberina, as concentrações de liberina, trofina e hormônio periférico estarão aumentadas. Se houver um aumento primário na liberação de trofinas, as concentrações de trofinas e de hormônios periféricos estarão aumentadas, mas a de liberinas reduzida. Se houver um aumento primário na liberação periférica do hormônio, a liberação de liberinas e trofinas será suprimida (retroalimentação negativa).
De uma maneira análoga, a deficiência primária de liberinas levará à deficiência de trofina e de hormônio periférico, enquanto a falta primária de trofinas resultará em liberação reduzida de hormônios periféricos, com liberação aumentada de liberinas; uma deficiência primária de hormônios periféricos levará à liberação aumentada de liberinas e trofinas.
Prolactina
A prolactina (PRL), hormônio produzido por células da adenohipófise (lactotrofos), é responsável por processos fisiológicos relacionados à reprodução, cuja principal função é a manutenção da lactação.
A prolactina estimula o crescimento e a diferenciação das glândulas mamárias, bem como a produção de leite (lactogênese), desempenhando um importante papel no processo de lactação. É liberada quando o mamilo é manipulado, seja pelo aleitamento (sucção) ou mediante estimulação mecânica ou manual (ordenha). Os estímulos sensoriais são levados ao hipotálamo, onde ocorre inibição dos neurônios secretores de PIH (hormônio inibidor da prolactina ou PRLIH, a dopamina) e maior liberação de PRLRH (hormônio liberador de prolactina), com consequente estímulo da secreção de prolactina pela adenohipófise, a qual, por sua vez, estimula a secreção alveolar de leite.
A prolactina também inibe a liberação pulsátil, mas não a basal, de gonadotrofinas [hormônio luteinizante (LH) e hormônio folículo-estimulante (FSH)], inibindo, assim, a ovulação. A prolactina ainda desempenha papel importante durante a resposta imunológica, afetando a proliferação e a diferenciação de muitas células do sistema imune.
Regulação da secreção de prolactina
A secreção de prolactina (PRL) é regulada tanto pela estimulação quanto pela inibição de neurohormônios do hipotálamo, dos quais a dopamina (hormônio inibidor da prolactina – PIH ou PRLIH), que é inibitória, é o fator regulador dominante.
A regulação hipotalâmica da secreção de prolactina baseia-se em sinais hipotalâmicos, de forma semelhante à de outros hormônios da adenohipófise. Um reflexo importante para a sua secreção é obtido através da estimulação dos mamilos das mamas durante o aleitamento ou ordenha (estimulação mecânica). Tal estimulação reduz a secreção de dopamina (hormônio inibidor da prolactina – PRLIH ou PIH) e, assim, aumenta a secreção de PRL.
Por outro lado, a estimulação sexual dos seios, da vagina e do colo do útero ativa a liberação de PRLRH (hormônio liberador de prolactina), de forma que a liberação de prolactina é também estimulada pelo orgasmo. Além disto, o hormônio sexual feminino estradiol (estrogênio dos ovários) também é capaz de estimular a secreção de prolactina, exercendo um efeito direto sobre as células produtoras de prolactina na adenohipófise (lactotrofos). Isso explica por que a concentração de prolactina no sangue aumenta durante a puberdade nas mulheres, e o estradiol presumivelmente contribui para o aumento da concentração de prolactina durante os últimos estágios da gravidez.
Além dos fatores citados, a prolactina é também regulada por outros agentes que estimulam sua secreção e entre eles estão a serotonina, o hormônio estimulador de tireotrofina (TRH) e os opiáceos.
Aumento de prolactina circulante (hiperprolactinemia)
Queixas clinicas como irregularidade menstrual, galactorreia (produção de leite nas mamas de homens ou de mulheres que não estão amamentando) e infertilidade são sintomas que indicam suspeita clínica de aumento no nível de prolactina (PRL) circulante (hiperprolactinemia).
Esse excesso de prolactina tem várias causa possíveis, que se enquadram em três principais categorias:
- patológicas: pode ser causado por tumores hipotalâmicos ou hipofisários, por insuficiência renal e/ou cirrose hepática (órgãos envolvidos com a metabolização e excreção da dopamina), e também pelo hipotireoidismo (secreção aumentada de hormônio liberador de tireotropina – TRH);
- fisiológicas: estresse;
- farmacológicas: administração de fármacos anti-dopaminérgicos.
Os efeitos do excesso de prolactina em mulheres que não estão amamentando e homens são galactorreia, tendência à hiperglicemia e inibição da liberação de gonadotrofinas, acompanhadas por hipogonadismo, amenorreia (falta de menstruação), perda de libido e impotência.
Para maiores informações sobre hiperprolactinemia, consulte:
- GONZAGA, M.F.M.; LUIZ AUGUSTO CASULARI, L.A. Diagnóstico e tratamento dos prolactinomas sensíveis ou resistentes aos agonistas dos receptores de dopamina. Brasília Med 2014; 51(3.4):225-236.
- SILVA, C.M.V.; ANDRADE, T.C. Prolactina e seus excessos em mulheres não gestantes. Universitas Ciências da Saúde 2005; 03(01): 101-107.
- VILAR, L.; NAVES, L.A.; GADELHA, M. Armadilhas no diagnóstico da hiperprolactinemia. Arq Bras Endocrinol Metab 2003; 47(4): 347-357.
Funções da prolactina e da ocitocina na amamentação
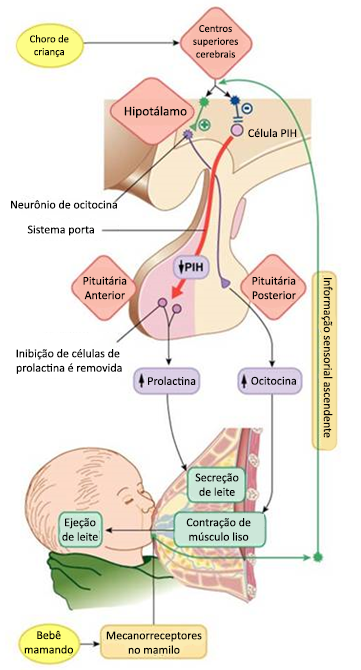
A ocitocina (hormônio hipotalâmico armazenado e secretado pela neurohipófise) se liga aos receptores nas células mioepiteliais localizadas nos alvéolos mamários, provocando contração destas células e, consequentemente, a ejeção do leite. A prolactina (PRL), hormônio adenohipofisário, desempenha um importante papel no processo de lactogênese (produção de leite), sendo liberada quando o mamilo é manipulado, seja pelo neonato (sucção) ou mediante estimulação mecânica ou manual (ordenha).
Os estímulos sensoriais são levados ao hipotálamo, onde ocorre a síntese de PRLRH (hormônio liberador de prolactina) e secreção de dopamina (PIH ou PRLIH), principal fator de inibição da prolactina. Há evidência que o polipeptídeo intestinal vasoativo (VIP) induz a secreção de PRLRH. Dois fatores possuem estreita relação com a liberação de PRL: em primeiro lugar, requer um tempo após o início da remoção do leite para atingir o pico máximo de secreção do hormônio, normalmente de 30 minutos. Em segundo lugar, é necessária a remoção permanente do leite em intervalo próximo a 12 horas para estimular a liberação de PRL. Os valores de PRL em circulação diminuem na medida que a lactação avança.
A ejeção do leite é devida a um reflexo neuroendócrino desencadeado pelo estímulo da sucção mamilar que, conduzido pelos nervos somáticos e medula espinal, chega ao hipotálamo. Nessa região, ocorre a inibição dos neurônios dopaminérgicos e maior liberação de prolactina, estimulando a secreção alveolar de leite. Além disso, há também, por mecanismo reflexo, a liberação de ocitocina pela hipófise posterior (neurohipófise). A ocitocina estimula a contração das células mioepiteliais que circundam os alvéolos mamários e a contração das paredes do canal galactóforo, permitindo a chegada do leite ao mamilo.
Hormônio do crescimento (GH)
O hormônio do crescimento (GH), também chamado hormônio somatotrópico ou somatotropina (somatotrofina), é produzido pelos somatotrofos, células mais numerosas na adenohipófise (cerca de 30% a 40% das células da adenohipófise são somatotrofos).
A liberação de GH pela adenohipófise é normalmente pulsátil, sendo estimulada pelo GHRH (hormônio de liberação do hormônio do crescimento) ou somatoliberina e inibida pelo GHIH (hormônio de inibição do hormônio do crescimento) ou somatostatina.
O GH não age por meio de glândula-alvo específica, exercendo seus efeitos diretamente sobre todos ou quase todos os tecidos do organismo. Ele provoca o crescimento de quase todos os tecidos do corpo que são capazes de crescer, promove o aumento de tamanho das células e do número de mitoses, causando a multiplicação e diferenciação específica de alguns tipos celulares, tais como as células de crescimento ósseo e células musculares iniciais.
Além de seu efeito geral de provocar o crescimento propriamente dito, o GH apresenta diversos efeitos metabólicos específicos, incluindo:
- aumento da captação de aminoácidos e da síntese proteica e redução do catabolismo das proteínas e dos aminoácidos na maioria das células do corpo;
- aumento da mobilização dos ácidos graxos do tecido adiposo, aumento do nível de ácidos graxos no sangue e aumento da utilização dos ácidos graxos como fonte de energia;
- redução da utilização da glicose pelo organismo.
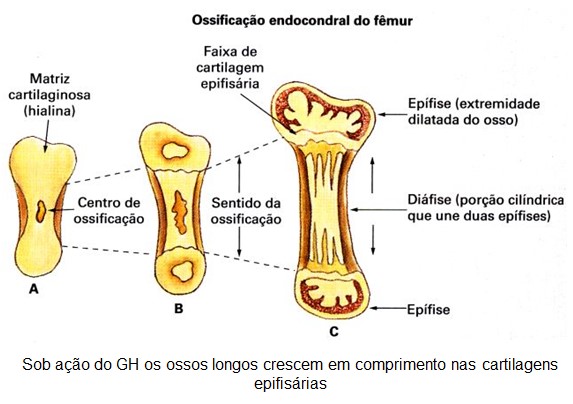
Assim, de fato, o hormônio do crescimento aumenta a quantidade de proteína do corpo, utiliza as reservas de gorduras e conserva os carboidratos, e seu efeito mais evidente, o crescimento ósseo, inclui:
- aumento da deposição de proteínas pelas células osteogênicas e condrócitos, que causam o crescimento ósseo;
- aumento da reprodução dessas células;
- efeito específico de conversão de condrócitos em células osteogênicas, ocasionando, assim, a deposição de osso novo.
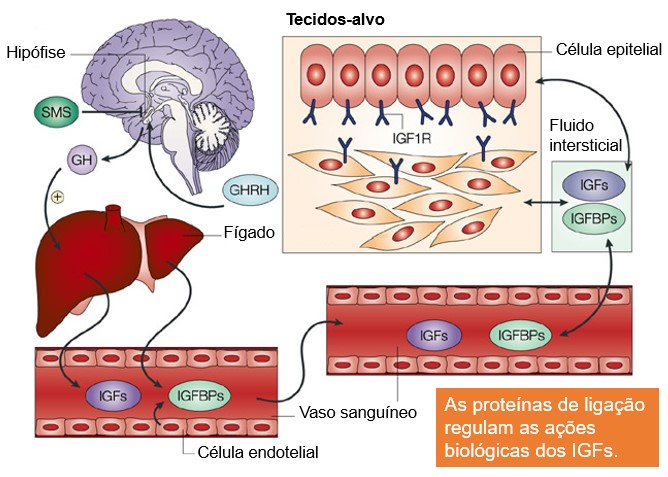
O GH exerce grande parte de seus efeitos pela estimulação da liberação de fatores de crescimento semelhantes à insulina – IGFs – ou somatomedinas, principalmente IGF-1 (somatomedina-C), sobretudo no fígado. Em resumo, o GH estimula o fígado (e, em muito menor extensão, outros tecidos que secretam IGF), a liberar as somatomedinas, que apresentam o potente efeito de aumentar todos os aspectos do crescimento ósseo.
O GH liga-se fracamente às proteínas plasmáticas. Consequentemente, é rapidamente liberado do sangue circulante para os tecidos, tendo meia-vida no sangue de menos de 20 minutos. Por outro lado, o IGF-1 liga-se fortemente a uma proteína transportadora no sangue (IGFBP), que também é produzida em resposta ao GH. Como consequência, o IGF-1 é liberado muito lentamente para os tecidos, com meia-vida de cerca de 20 horas. Isto prolonga muito os efeitos dos picos de secreção do GH sobre o processo de crescimento.
OBS.:
Muitos dos efeitos das somatomedinas no crescimento são similares aos efeitos da insulina no crescimento. Por isso, as somatomedinas são também chamadas fatores de crescimento semelhantes à insulina (IGFs).
O fígado é o órgão central no eixo do hormônio do crescimento/fator de crescimento semelhante à insulina (GH/IGF), sendo de extrema importância para os efeitos fisiológicos do GH. Várias proteínas de ligação ao IGF (IGFBPs) são também produzidas no fígado, prolongando os efeitos do GH.
Excesso de hormônio do crescimento (gigantismo e acromegalia)
O excesso de hormônio do crescimento (GH) é, em geral, decorrente de sua produção descontrolada por um adenoma (tumor) hipofisário secretor de GH (somatotropinoma) ou, em casos raros, por um tumor ectópico secretor de GH. A hipersecreção eutópica ou ectópica de GHRH é igualmente rara. A administração terapêutica não controlada de GH pode também resultar em seu excesso.
As células somatotrópicas coram-se intensamente com corantes ácidos e, portanto, são chamadas acidófilas. Por isso, os tumores hipofisários que secretam grande quantidade de GH são chamados tumores acidófilos.
Se o distúrbio ocorrer antes da adolescência, isto é, antes da fusão das epífises com as diáfises dos ossos longos, leva ao gigantismo, onde todos os tecidos do corpo crescem rapidamente, inclusive os ossos, e, o indivíduo cresce em altura, transformando-se em um gigante de até 2,40 a 2,70 m.

Se houver desenvolvimento de tumor acidófilo após a adolescência, isto é, após a fusão das epífises com as diáfises dos ossos longos, resulta em acromegalia. Nesse caso, o indivíduo não pode mais crescer em altura; entretanto ocorre aumento pronunciado dos ossos das mãos, dos pés e dos ossos membranosos, incluindo crânio, nariz, proeminências na testa, cristas supraorbitárias, mandíbula (protrusão) e porções das vértebras (cifose), e os tecidos moles como língua, coração (hipertrofia miocárdica), fígado, rins, tireoide, glândulas salivares e pele também aumentam enormemente.
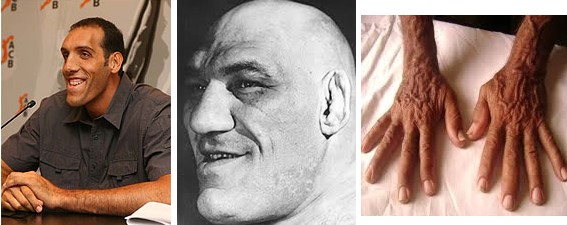
Esse aumento no tamanho dos órgãos pode levar a complicações. Se, por exemplo, a vascularização não aumentar com a hipertrofia miocárdica, ocorrerá redução do fornecimento coronariano de oxigênio (angina pectoris). A hipertensão arterial também ocorre em 30% dos casos. O espessamento da pele está associado ao aumento da sudorese e secreção sebácea. A absorção intestinal aumentada resulta em excesso de cálcio seguido de hipercalciúria, que pode causar precipitação de sais de cálcio na urina (nefrolitíase). O excesso de GH também promove o desenvolvimento de pólipos colônicos e tumores.
Ainda, em ambos os casos (gigantismo e acromegalia), a captação diminuída da glicose em células periféricas favorece o desenvolvimento de hiperglicemia, e as células beta () das ilhotas de Langerhans do pâncreas tendem a degenerar, em parte devido à sua hiperatividade, decorrente da hiperglicemia, e em parte, devido a um efeito direto de estimulação excessiva do GH sobre as células das ilhotas pancreáticas. Consequentemente, em cerca de 10% dos indivíduos, verifica-se finalmente o desenvolvimento de diabetes melito.
O excesso de GH estimula a secreção hepática de IGF-1, que causa a maioria das manifestações clínicas da acromegalia.
Para maiores informações sobre acromegalia, consulte:
- MINISTÉRIO DA SAÚDE. Protocolo clínico e diretrizes terapêuticas da acromegalia. Brasília/DF, 2020. Disponível em: <http://conitec.gov.br/images/Protocolos/Publicacoes_MS/PCDT_Acromegalia_ISBN.pdf> Acesso em 01/07/2021.
- SECRETARIA MUNICIPAL DE ASSISTÊNCIA SOCIAL/MS (SAS/MS). Acromegalia. Portaria SAS/MS nº 471, de 23 de julho de 2002. Disponível em: <https://www.saudedireta.com.br/docsupload/1340028840do_a02_01.pdf> Acesso em 01/07/2021.
- SECRETARIA MUNICIPAL DE ASSISTÊNCIA SOCIAL/MS (SAS/MS). Protocolo Clínico e Diretrizes Terapêuticas: Acromegalia. Portaria SAS/MS nº 199, de 25 de fevereiro de 2013, republicada em 22 de novembro de 2013. Disponível em: <https://portalarquivos2.saude.gov.br/images/pdf/2014/abril/02/pcdt-acromegalia-livro-2013.pdf> Acesso em 01/07/2021.
Deficiência de hormônio do crescimento (nanismo)
A maioria dos casos de nanismo resulta da deficiência generalizada da secreção adenohipofisária (nanismo hipofisário ou hipopituitarismo) durante a infância (secreção reduzida de todos os hormônios da hipófise anterior), ocorrendo em 1 a cada 8.000 indivíduos. Em geral, os elementos corporais desenvolvem-se proporcionalmente entre si, mas a velocidade de desenvolvimento fica acentuadamente reduzida. Sem tratamento hormonal adequado (reposição de GH, corticoide, tiroxina, além de testosterona, quando são homens, e estrogênio e progesterona, quando são mulheres), o anão com hipopituitarismo não passa pela fase da puberdade e nunca secreta quantidades suficientes de hormônios gonadotrópicos (FSH e LH) para o desenvolvimento das funções sexuais adultas, apresentando voz aguda, hipogonadismo hipogonadotrófico, micropênis (no caso do sexo masculino), gordura aumentada (principalmente no abdômen) e propensão à hipoglicemia.
Todavia, em um terço dos anões, a deficiência afeta apenas o GH. Esses indivíduos amadurecem sexualmente e, em certas ocasiões, chegam a se reproduzir.
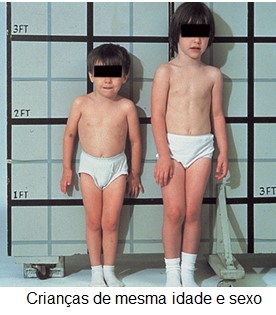
Em um outro tipo de nanismo (o pigmeu africano e o anão de Levi-Lorain), a velocidade de secreção de hormônio do crescimento está normal ou elevada, mas existe incapacidade hereditária de produzir IGF-1 em resposta ao hormônio do crescimento.

A deficiência de GH pode ser determinada geneticamente ou ser consequência de lesão nas células produtoras de hormônio (p. ex., tumor, hemorragia, radiação). O efeito do GH pode também ser enfraquecido por outros fatores, como má nutrição e hipoinsulinismo (deficiência de insulina), ou ainda ser abolido por defeitos genéticos do receptor (insensibilidade ao GH ou síndrome de Laron).
Uma deficiência de GH, que ocorre após o final do crescimento longitudinal, resultará em massa muscular reduzida, tecido adiposo aumentado, hiperlipidemia, aterosclerose, enfraquecimento do sistema imune, desmineralização óssea e distúrbios psicológicos (depressão e isolamento social).
Para maiores informações sobre nanismo, consulte:
- GARMES, H.M.; BOGUSZEWSKI, C.L.; MIRANDA, P.A.C.; MARTINS, M.R.A.; DA SILVA, S.R.C.; ABUCHAM FILHO, J.Z.; MUSOLINO, N.R.C.; VILAR, L.; PORTARI, L.H.C.; GADELHA, M.R.; KASUKI, L.; NAVES, L.A.; CZEPIELEWSKI, M.A.; DE ALMEIDA, T.S.; DUARTE, F.H.G.; GLEZER, A.; BRONSTEIN, M.D. Management of hypopituitarism: a perspective from the Brazilian Society of Endocrinology and Metabolism. Arch Endocrinol Metab 2021; 65(2): 212-230.
- JORGE, A.A.L.; PEREIRA, M.A.A. Investigação de baixa estatura: aspectos clínicos, laboratoriais e moleculares da insensibilidade ao hormônio de crescimento. Arq Bras Endocrinol Metab 2009; 52(6): 1056-1065.
Os demais hormônios trópicos da adenohipófise, que exercem seus efeitos principalmente por meio do estímulo de glândulas-alvo, serão abordados nos tópicos respectivos de cada glândula-alvo.