Músculo esquelético

Quase 700 músculos esqueléticos individuais compõem a musculatura esquelética, de modo que esta musculatura constitui cerca de 40% do peso corporal, formando o que se chama popularmente de carne. É responsável pela locomoção, expressão facial, postura, funções respiratórias e muitos outros movimentos corporais. O sistema nervoso controla de modo voluntário (consciente) as funções desses músculos.
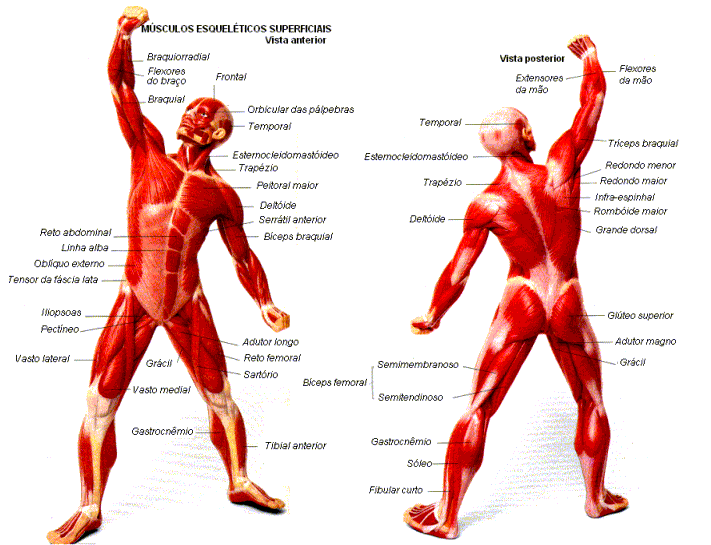
A função da maioria dos músculos esqueléticos é produzir movimentos de partes do corpo. Alguns músculos atuam, basicamente, para estabilizar os ossos, de forma que outros músculos esqueléticos executem um movimento com mais eficiência.
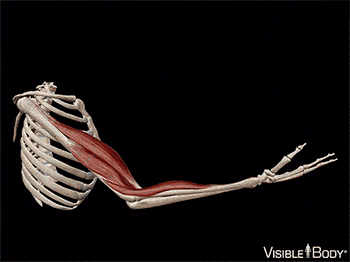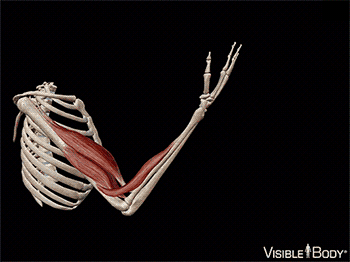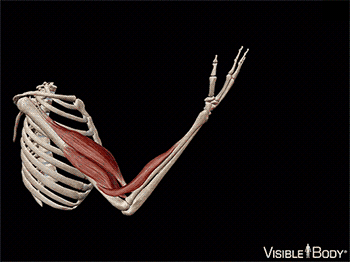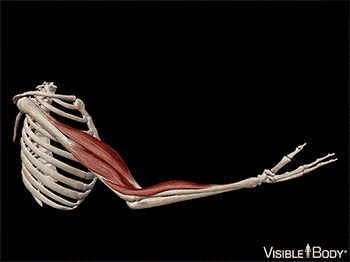
A maior parte desses músculos estende-se de um osso a outro e cruza pelo menos uma articulação. A contração muscular leva à multiplicidade dos movimentos corporais, puxando um dos ossos em relação ao outro por meio de uma articulação móvel. Alguns músculos não estão ligados aos ossos nas duas extremidades. Por exemplo, alguns músculos faciais estão ligados à pele, que se move à medida que a musculatura contrai.
Anatomia macroscópica do músculo esquelético
Cada músculo esquelético é um órgão distinto formado por vários tipos de tecido. Embora predominem as fibras musculares esqueléticas, também estão presentes os vasos sanguíneos e as fibras nervosas, que penetram nos músculos, e uma quantidade significativa de tecido conjuntivo envolvendo o tecido muscular.
A forma de um músculo esquelético e suas fixações no corpo podem ser observadas facilmente sem o auxílio de um microscópio.
Organização do músculo esquelético
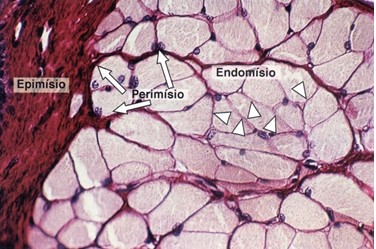
O músculo esquelético é formado por feixes de células cilíndricas muito longas e multinucleadas (fibras musculares) que estão organizadas em grupos de feixes (ou fascículos), sendo o conjunto de feixes envolvidos por uma camada de tecido conjuntivo chamada epimísio, que recobre o músculo inteiro.
Do epimísio partem finos septos de tecido conjuntivo que se dirigem para o interior do músculo, separando os feixes. Esses septos constituem o perimísio. Assim, o perimísio envolve cada feixe de fibras. Cada fibra muscular individualmente é envolvida pelo endomísio, que é formado pela lâmina basal da fibra muscular, associada a fibras reticulares. O endomísio apresenta escassa população celular constituída por algumas células do tecido conjuntivo, principalmente fibroblastos.
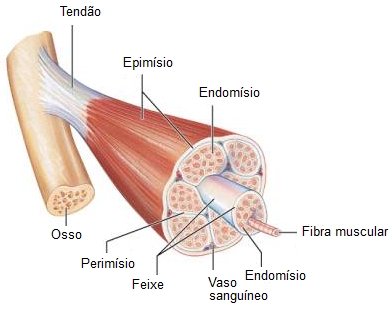 |  |
O tecido conjuntivo mantém as fibras musculares unidas permitindo que a força de contração gerada por cada fibra individualmente atue sobre o músculo inteiro. Este papel do conjuntivo tem grande significado funcional porque na maioria das vezes as fibras não se estendem de uma extremidade do músculo até a outra. Além disso, a força da contração do músculo pode ser regulada pela variação do número de fibras estimuladas pelos nervos. É ainda por intermédio do tecido conjuntivo que a força de contração do músculo se transmite a outras estruturas como tendões e ossos. Os vasos sanguíneos penetram no músculo através dos septos de tecido conjuntivo e formam extensa rede de capilares que correm as fibras musculares. O tecido conjuntivo do músculo contém ainda vasos linfáticos e nervos.
Alguns músculos se afilam nas extremidades, observando-se uma transição gradual de músculo para tendão. Nessa região de transição, as fibras de colágeno do tendão se inserem em dobras complexas do sarcolema.
Organização das fibras musculares esqueléticas
O sarcolema das fibras musculares esqueléticas consiste em uma membrana plasmática e um revestimento de uma fina camada contendo muitas fibrilas colágenas delgadas. Em cada extremidade da fibra muscular, a camada superficial do sarcolema funde-se com uma fibra do tendão, e esta (fibra do tendão), por sua vez, se agrupa em feixes para formar os tendões dos músculos que se inserem nos ossos.
No sarcoplasma de cada fibra muscular existem muitos feixes cilíndricos, as miofibrilas, que medem 1 a 2 m de diâmetro e são paralelas ao eixo maior da fibra muscular. As miofibrilas são constituías por filamentos proteicos, os miofilamentos, onde são encontradas as unidades contráteis dos músculos esquelético e cardíaco, os sarcômeros.
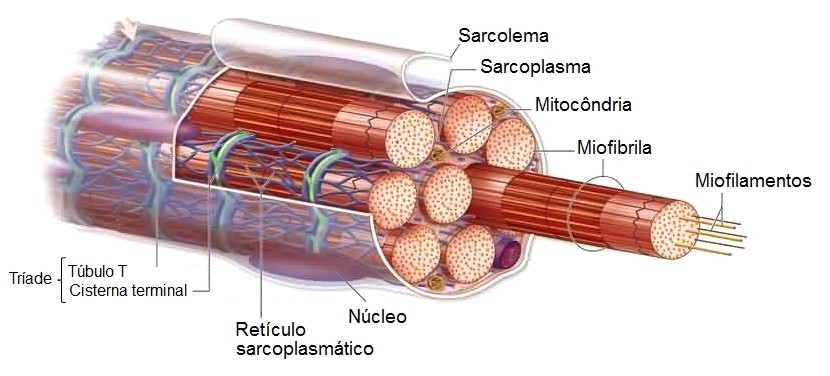
No sarcoplasma também há grande quantidade de grânulos de glicogênio (reserva energética) e quantidades significativas de mioglobina, uma proteína de ligação com oxigênio que atua como reserva de oxigênio nos músculos esquelético e cardíaco. Igualmente, estão presentes grande número de mitocôndrias (denominadas sarcossomas), localizadas paralelamente às miofibrilas. Elas fornecem às miofibrilas que se contraem grande quantidade de energia na forma de ATP.
Existe ainda no sarcoplasma, circundando as miofibrilas, extenso retículo sarcoplasmático (retículo endoplasmático liso), especializado no armazenamento de íons cálcio. Esse retículo tem uma organização especial com o sarcolema (túbulos T formando as tríades), que é extremamente importante para o controle da contração muscular. O citosol preenche os espaços entre as miofibrilas e contém grandes quantidades de potássio, magnésio, fosfato e enzimas, particularmente aquelas envolvidas na via de obtenção de energia (via glicolítica).
Organização das miofibrilas
Quando observadas ao microscópio óptico, as fibras musculares esqueléticas mostram estriações transversais, pela alternância de faixas claras e escuras.
Ao microscópio de polarização, a faixa escura é anisotrópica, isto é, têm propriedades ópticas que variam com a orientação da luz incidente; por isso, recebe o nome de banda A. No centro da banda A nota-se uma região mais clara, a zona H.
A faixa clara, ou banda I, é isotrópica, ou seja, demonstra as mesmas propriedades ópticas em todas as direções. No centro de cada banda I nota-se uma linha transversal escura – a linha Z.

OBS.:
A luz polarizada é criada pela passagem de luz através de um filtro de polarização. Isso transmite a luz em apenas uma direção. Existem dois filtros de polarização no microscópio de polarização - acima e abaixo da amostra (o polarizador e o analisador). A forma na qual os materiais interagem com a luz polarizada pode fornecer informações sobre sua estrutura e composição.
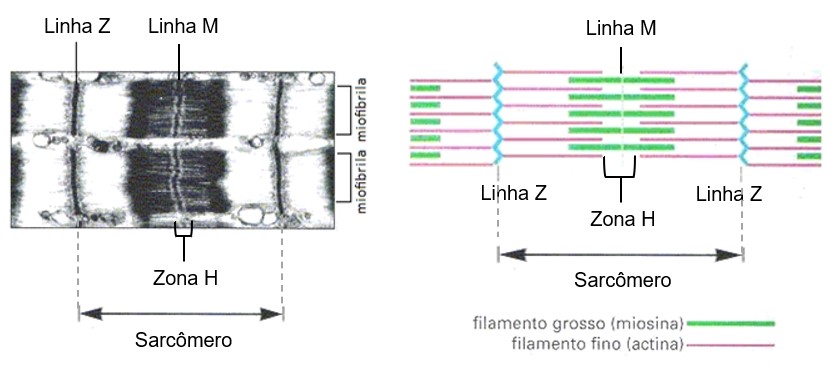
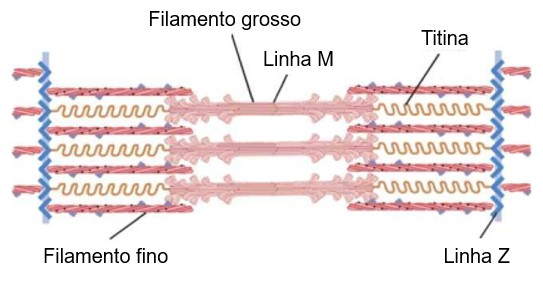
A estriação da miofibrila é devida à repetição de unidades iguais, chamadas sarcômeros. Cada sarcômero mede cerca de 2,5 m e é formado pela parte da miofibrila que fica entre duas linhas Z sucessivas e contém uma banda A separando duas semibandas I.
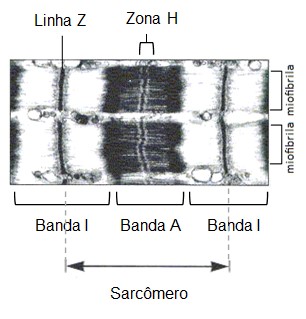
Da linha Z, partem os filamentos finos (actina, tropomiosina e troponina) que vão até o bordo externo da banda H. Os filamentos grossos (miosina) ocupam a região central do sarcômero. Como resultado dessa disposição, a banda I é formada somente por filamentos finos, a banda A é formada por filamentos finos e grossos, e a zona H, somente por filamentos grossos. Na região lateral da banda A, os filamentos finos e grossos se interligam. Finalmente, dentro da zona de H há uma linha fina central (linha M) formada de elementos de interligação do citoesqueleto.
Miofilamentos
As miofibrilas do músculo estriado contêm quatro proteínas (miofilamentos) principais:
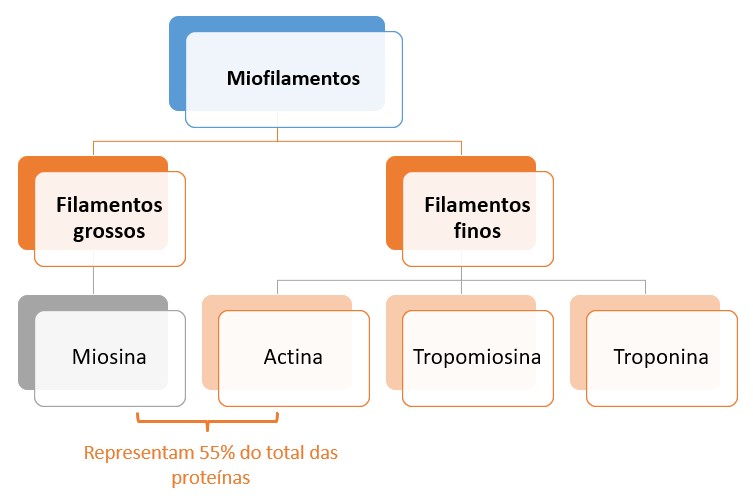
- miosina
- actina
- tropomiosina
- troponina
Os filamentos grossos são formados de miosina e as outras três proteínas são encontradas nos filamentos finos. A miosina e a actina, juntas, representam 55% do total das proteínas do músculo estriado.
Filamentos grossos
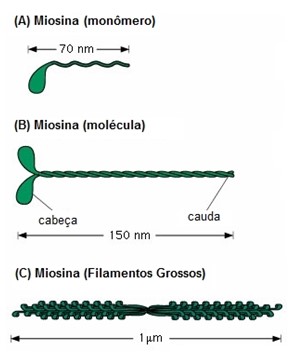
A miosina é o componente dos filamentos grossos. Cada molécula de miosina (B na figura ao lado) é grande, tem formato de bastão e é composta por duas cadeias polipeptídicas (A - monômero na figura ao lado) enroladas em hélice.
Em uma de suas extremidades, a miosina apresenta uma saliência globular ou cabeça, que possui três regiões distintas:
- uma região de ligação à actina;
- uma região de ligação ao ATP e dotada de atividade ATPásica (é nesta parte da molécula que ocorre a hidrólise de ATP para liberar a energia utilizada na contração);
- uma região de ligação a uma cadeia leve.
Quando molécula de miosina é submetida à ligeira proteólise (tratamento com tripsina), produz dois tipos fragmentos:
- meromiosina pesada ou cadeia pesada,
- meromiosina leve ou cadeia leve.
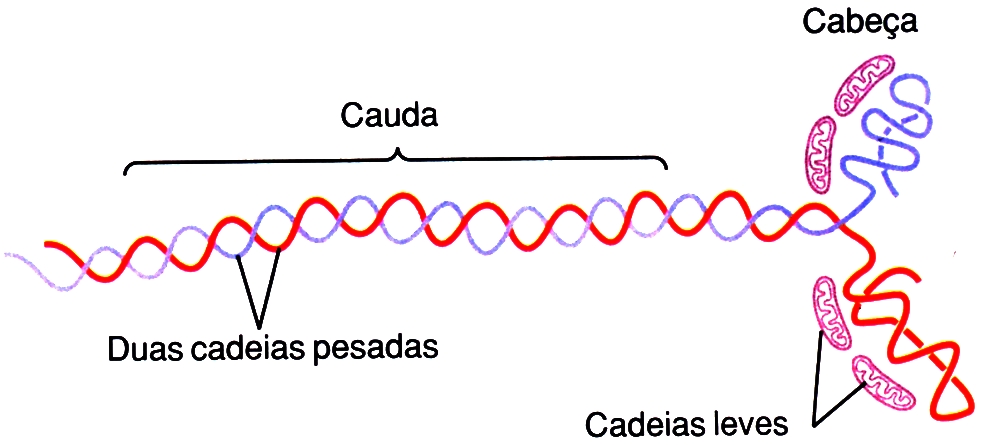
Na molécula de miosina existem duas cadeias pesadas idênticas e dois pares de cadeias leves. As cadeias pesadas contêm a cabeça e a parte em forma bastão (cauda) da molécula (caudas enroladas em hélice na molécula). As cadeias leves fazem parte da cabeça (2 cadeias leves para cada cabeça) e ajudam a regular seu funcionamento durante a contração muscular.
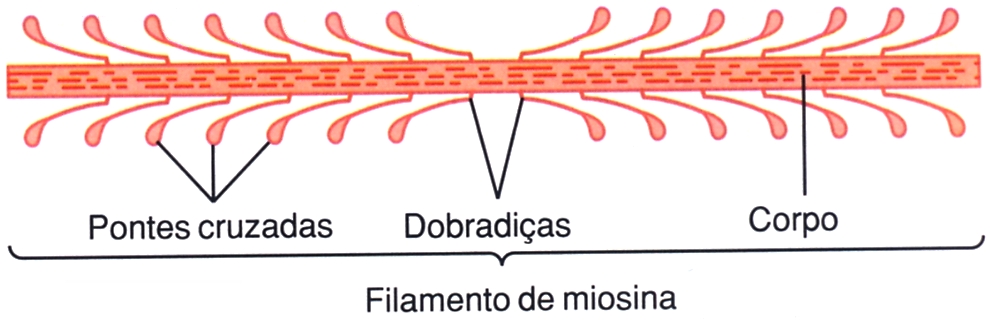
Os filamentos grossos são formados por 200 ou mais moléculas de miosina dispostas de tal maneira que suas caudas se agrupam em feixes para formar o corpo do filamento, enquanto as cabeças se projetam para fora nos lados do corpo (C, na figura de cima). Também, partes do corpo estão penduradas nas partes laterais, junto com as cabeças, formando assim um braço que estende a cabeça para fora do corpo. As projeções dos braços e das cabeças formam as pontes cruzadas. Cada ponte cruzada é flexível em dois locais, designados como dobradiças — um na junção entre o braço e o corpo do filamento de miosina, e o outro no ponto de ligação da cabeça ao braço. Os braços móveis permitem que as cabeças sejam estendidas, afastando-se do corpo do filamento de miosina. Já as cabeças móveis participam sucessivamente do processo real da contração.
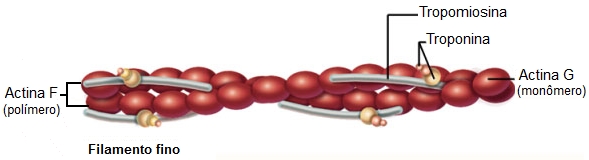
Filamentos finos
Os filamentos finos são compostos por actina, tropomiosina e troponina.
A actina apresenta-se sob a forma de polímeros longos (actina F) formados por duas cadeias de monômeros globulares (actina G), torcidas uma sobre a outra em dupla hélice. Os monômeros de actina G são assimétricos (um lado é diferente do outro). Quando esses monômeros se polimerizam para formar a actina F, a frente de um monômero combina-se com a parte posterior do outro (de uma maneira cabeça-cauda), produzindo um filamento de actina F que, como cada monômero de actina G, é também polarizado.
Cada monômero globular de actina G tem uma região que interage com a miosina. No sarcômero, os filamentos de actina ancorados perpendicularmente em cada lado da linha Z exibem polaridades opostas em cada lado dessa linha.
A tropomiosina é uma molécula longa e fina constituída por duas cadeias polipeptídicas enroladas uma na outra. As moléculas de tropomiosina unem-se umas às outras pelas extremidades, para formar filamentos que se localizam ao longo do sulco formado pelos dois filamentos de actina F. Cada molécula de tropomiosina estende-se ao longo de sete monômeros de actina e liga-se ao complexo da troponina.
A troponina é um complexo formado por três subunidades:
- troponina T (TnT), que se liga fortemente à tropomiosina;
- troponina I (TnI), que inibe a ligação da miosina à actina (cobre o sítio ativo da actina, no qual ocorre a interação da actina com a miosina);
- troponina C (TnC), que tem grande afinidade e se liga aos íons cálcio (Ca2+), sendo encontrada apenas nos tecidos musculares estriados.
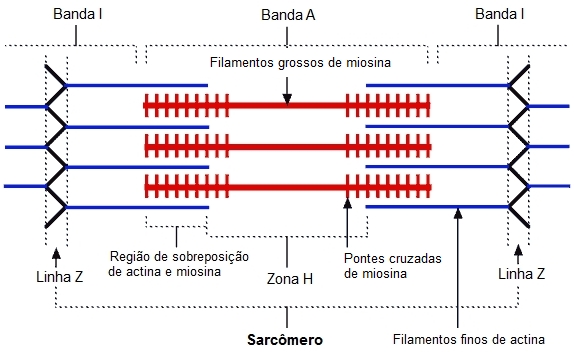
Interação dos miofilamentos no sarcômero
Como visto anteriormente, a disposição dos filamentos grossos e finos no sarcômero é responsável pelo padrão em bandas ou estriações transversais observado à microscopia. A actina e a miosina interagem e geram a força de contração.
Os miofilamentos finos formam a banda I, enquanto a banda A é formada por filamentos finos e grossos. A parte central da banda A, que corresponde à zona H, representa uma região de sobreposição de miosinas, constituída exclusivamente pela parte em bastão (cauda) das moléculas. No centro da banda H, a linha M corresponde às ligações laterais entre filamentos grossos adjacentes. A linha Z forma um suporte transversal para os sarcômeros, o que assegura a transmissão eficiente da força gerada.
Como os filamentos de actina são polarizados, isto é, possuem uma extremidade (+) e uma (−), eles se inserem nas linhas Z sempre pela extremidade (+). Assim, os filamentos de actina de cada semibanda clara (banda I) do sarcômero estarão sempre em oposição, o que explica muito bem por que os filamentos à esquerda se deslocam para a direita e os da direita para a esquerda (ver Mecanismo geral de contração muscular).
Proteínas acessórias
A estrutura do sarcômero é mantida por várias proteínas acessórias.
O posicionamento lado a lado dos filamentos de miosina e actina é difícil de ser mantido. Essa manutenção é realizada pelo grande número de moléculas filamentares da proteína chamada titina, maior molécula de proteína do corpo e também muito flexível. Essa flexibilidade das moléculas de titina atua como arcabouço que mantém os filamentos de miosina e actina em seus lugares, de modo que a maquinaria contrátil possa entrar em ação. Uma extremidade da molécula de titina é elástica e se encontra fixada à linha Z, atuando como mola e variando seu comprimento conforme o sarcômero contrai e relaxa. A outra parte da molécula de titina a ancora nos filamentos grossos de miosina.
A linha Z apresenta como componente primário as -actininas (ACTN), proteínas do citoesqueleto que cruzam os filamentos finos. Elas desempenham uma função de manutenção do arranjo miofibrilar, bem como função regulatória na coordenação da contração fibromuscular. As ACTN-2 e ACTN-3 são as principais constituintes estruturais da linha Z que se ancoram à actina nos filamentos finos, além de manter relação espacial entre os miofilamentos. Admite-se que essas interações sejam fundamentais para a ancoragem de sarcômeros adjacentes e para a ligação das moléculas de titina, situadas nas metades opostas de sarcômeros adjacentes.
Na linha Z existe também uma proteína denominada -actinina (ou CapZ), que atua como elemento estabilizador da polimerização dos filamentos de actina, juntamente com a tropomodulina: os filamentos de actina são estabilizados nas suas extremidades (+) por CapZ e nas suas extremidades (–) pela tropomodulina. Ao estabilizar a polimerização da actina e ligar-se às sua terminações livres, previne a adição ou a perda de monômeros de actina.
Uma outra proteína gigante conhecida como nebulina se estende ao longo do filamento fino de actina, por toda sua extensão, desde a linha Z até a tropomodulina, à qual ela se liga. Acredita-se que o comprimento da nebulina determina o comprimento dos filamentos finos durante o desenvolvimento do músculo.

A principal proteína da linha M é a creatinoquinase ou creatina quinase (CK), uma enzima que catalisa a transferência reversível de um grupo fosfato da fosfocreatina para o ADP, resultando no ATP utilizado nas contrações musculares (ver Fontes de energia para a contração muscular). A linha M também contém outras proteínas, tais como proteína M, miomesina, obscurina e anquirina. Essas proteínas interagem com a titina e ligam filamentos grossos adjacentes no centro da banda A.
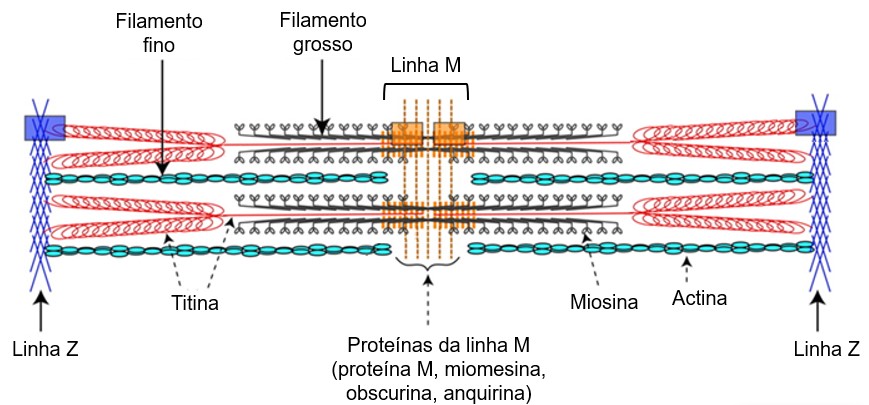
Muitas outras proteínas estão presentes nas fibras musculares e são fundamentais para a estruturação e organização das miofibrilas, apresentando um importante papel nos aspectos funcionais do músculo esquelético.
O sarcômero, por exemplo, é ancorado às integrinas (proteínas transmembranares de adesão/ancoragem do sarcolema) por meio de uma série de proteínas da linha Z, incluindo -actinina, vinculina e talina, entre outras. Juntas, essas moléculas formam o complexo juncional que conecta a maquinaria contrátil às proteínas da matriz extracelular laminina e colágeno IV.
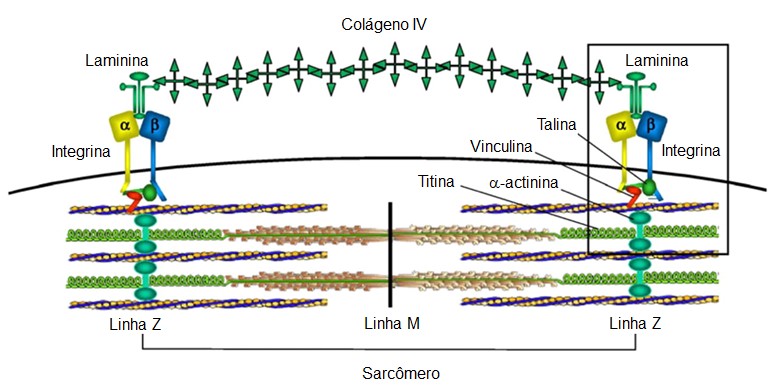
Além disto, o conjunto de miofibrilas é preso ao sarcolema por meio de diversas proteínas que têm afinidade pelos miofilamentos e por proteínas do sarcolema. Uma destas proteínas é a distrofina, proteína do citoesqueleto ligada à face citoplasmática do sarcolema que liga os filamentos de actina a proteínas da membrana e forma um complexo distrofina-glicoproteína funcional que conecta a matriz extracelular e o citoesqueleto na célula muscular. Sua deficiência causa instabilidade e rompimento do sarcolema. Sua função precisa função precisa ainda não está esclarecida, mas um papel possível dessa proteína pode estar relacionado à integridade e alinhamento da membrana plasmática às miofibrilas durante a contração muscular e relaxamento (e não à sustentação da membrana).
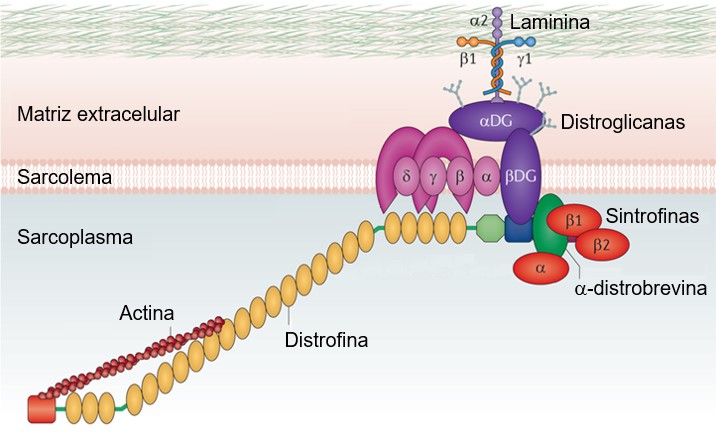
OBS.:
Mutações no gene da distrofina, localizado no cromossomo X (Xp21), levam a deficiência da distrofina nos músculos esquelético e cardíaco, cansando distrofinopatias (Duchenne, Becker e formas intermediárias). São caracterizadas por causar fraqueza, degeneração e atrofia em grupos de músculos esqueléticos específicos de caráter progressivo e irreversível e cujas alterações patológicas são secundárias à deficiência da proteína distrofina e independem do comprometimento orgânico ou funcional do sistema nervoso central ou periférico. A progressão é grave com insuficiência cardiorrespiratória terminal nos jovens adultos com distrofia muscular de Duchenne (DMD); distrofia muscular de Becker (BMD) é lenta e a sua esperança de vida é subnormal a normal.
No contexto apresentado, podemos perceber que em uma fibra muscular estriada há um conjunto complexo de proteínas que atuam como contráteis, regulatórias e componentes do citoesqueleto.
Para maiores informações sobre proteínas acessórias, consulte:
- BRANCACCIO, M.; HIRSCH, E.; NOTTE, A.; SELVETELLA, G.; LEMBO, G.; TARONE, G. Integrin signalling: the tug-of-war in heart hypertrophy. Cardiovasc Res 2006; 70(3): 422-433.
- CASTRO-FERREIRA, R.; FONTES-CARVALHO, R.; FALCÃO-PIRES, I.; LEITE-MOREIRA, A.F. Papel da titina na modulação da função cardíaca e suas implicações fisiopatológicas. Arq Bras Cardiol 2011; 96(4): 332-339.
- FAIRCLOUGH, R.; WOOD, M.; DAVIES, K. Therapy for Duchenne muscular dystrophy: renewed optimism from genetic approaches. Nat Rev Genet 2013; 14, 373-378.
- GAO, Q.Q.; MCNALLY, E.M. The Dystrophin Complex: Structure, Function, and Implications for Therapy. Compr Physiol 2015; 5(3): 1223-1239.
- KATZ, A.M.; ZILE, M.R. New molecular mechanism in diastolic heart failure. Circulation 2006; 113(16): 1922-1925.