
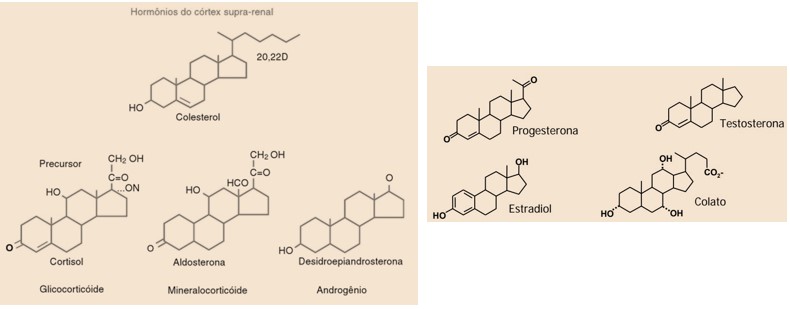
Colesterol
O colesterol é um membro da família dos lipídios esteroides e, na sua forma pura, é um sólido cristalino, branco, insípido e inodoro. Apesar da má fama, o colesterol é um composto essencial para a vida, estando presente nos tecidos de todos os animais. Além de fazer parte da estrutura das membranas celulares, é também um reagente de partida para a biossíntese de vários hormônios (cortisol, aldosterona, testosterona, progesterona, estradiol), dos sais biliares (ex.: colato) e da vitamina D.
O colesterol é obtido por meio de síntese celular (colesterol endógeno - 70%) e da dieta (colesterol exógeno - 30%). Exceto em pessoas com alterações genéticas do metabolismo do colesterol, o excesso dele no sangue resulta dos péssimos hábitos alimentares (que são adquiridos desde a infância) que nos levam a grande ingestão de alimentos ricos em colesterol e gorduras saturadas (geralmente de origem animal).
O colesterol endógeno é sintetizado pelo fígado, em um processo regulado por um sistema compensatório: quanto maior for a ingestão de colesterol vindo dos alimentos, menor é a quantidade sintetizada pelo fígado.
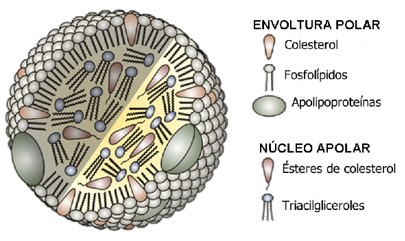
O colesterol é insolúvel em água; assim, para ser transportado na circulação sanguínea liga-se a algumas proteínas (denominadas apoproteínas ou apolipoproteínas – apo) e outros lipídeos através de ligações não-covalentes, em um complexo chamado lipoproteína.
Existem vários tipos de lipoproteínas, e estas podem ser classificadas de diversas maneiras. O modo pelo qual os bioquímicos geralmente as classificam é baseado em sua densidade. Entre estas, estão as "Low-Density Lipoproteins", ou LDL, que transportam o colesterol do sítio de síntese o fígado até as células de vários outros tecidos. Uma outra classe de lipoproteínas, as "High Density Lipoproteins", ou HDL, transportam o excesso de colesterol dos tecidos de volta para o fígado (transporte reverso), onde é utilizado para a síntese dos sais biliares.
Lipoproteínas
O termo lipoproteína é empregado para uma família de partículas cuja finalidade é transportar lipídeos, principalmente triglicerídeos TG (triglicérides ou triacilgliceróis) e colesterol, entre órgãos e tecidos. Uma partícula lipoproteica é composta por um centro contendo lipídeos apolares (triglicerídeos e ésteres do colesterol) e uma membrana de fosfolipídios que constitui o limite externo da partícula e sua interface com o plasma. Nesta membrana estão inseridos colesterol livre e várias proteínas denominadas apolipoproteínas ou apoproteínas (apo), que diferem segundo o tipo de partícula.
A estrutura básica das lipoproteínas é comum a todas, variando o tamanho e a proporção entre seus componentes.
As lipoproteínas são classificadas em várias classes, de acordo com a natureza e quantidade de lipídeos e tipos e quantidades de proteínas que as constituem. Dentre as classes de lipoproteínas destacam-se:
- quilomícrons (Qm),
- lipoproteínas de muito baixa densidade (VLDL, do inglês very low density lipoproteins),
- lipoproteínas de densidade intermediária (IDL, do inglês intermediate density lipoprotein),
- lipoproteínas de baixa densidade (LDL, do inglês low density lipoproteins),
- lipoproteínas de alta densidade (HDL, do inglês high density lipoproteins).
OBS.:
As lipoproteínas ricas em triglicerídeos (TG) são os quilomícrons, as VLDL e seus respectivos remanescentes. Os quilomícrons são formados no intestino a partir das gorduras da dieta. Cerca de 85% a 90% de sua composição lipídica são formados pelos TG. As VLDL são partículas sintetizadas pelo fígado, cuja composição de TG é de cerca de 50% a 65%.
Apolipoproteínas ou apoproteínas (apo)
As lipoproteínas possuem regiões centrais hidrofóbicas contendo ésteres de colesterol e triglicerídeos, circundadas por colesterol não esterificado, fosfolipídeos e as apolipoproteínas ou apoproteínas (apo), componente proteico responsável pela estabilização da sua estrutura e com diferentes funções no metabolismo lipídico. Estas apo são classificadas como:
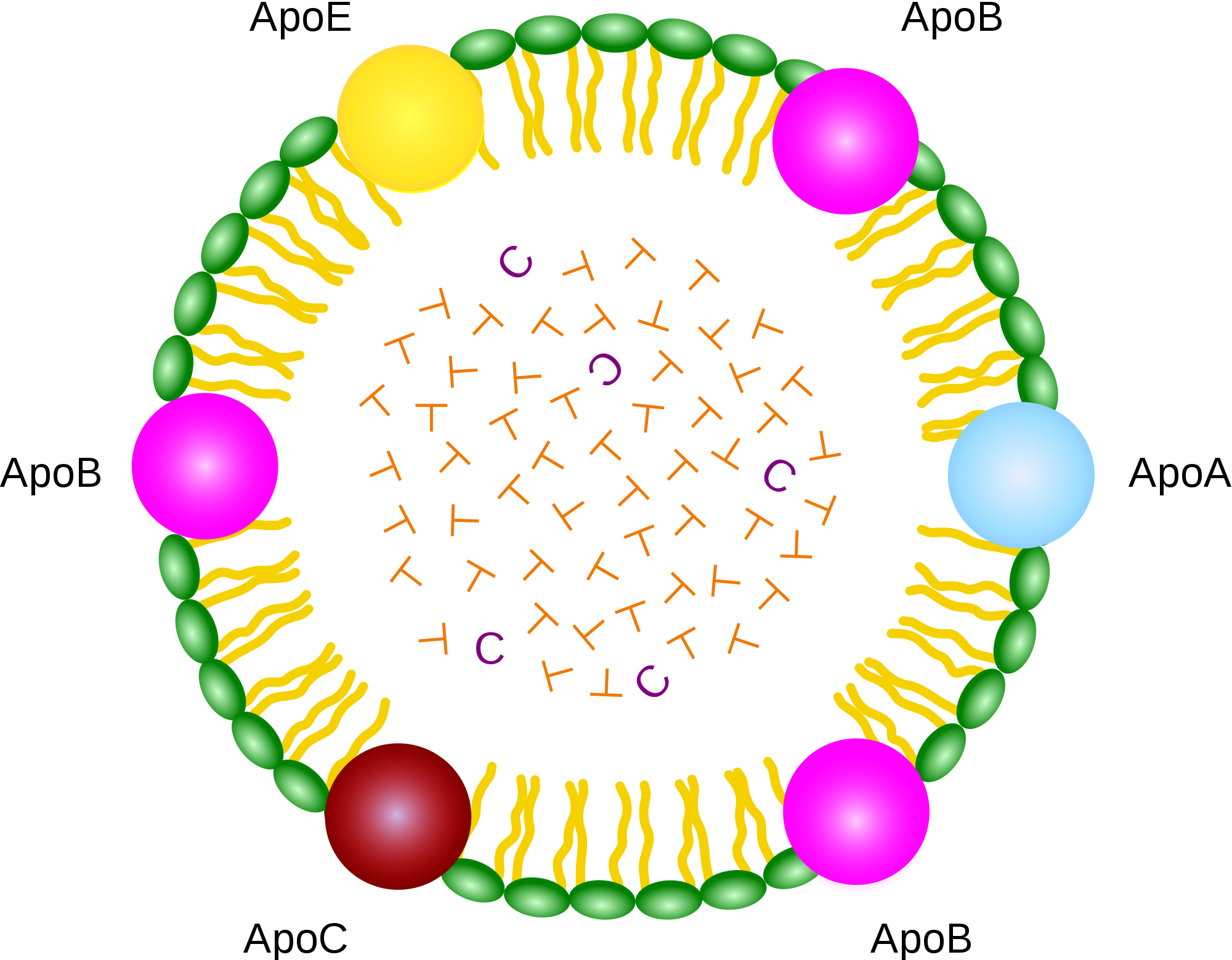
- apo A (apoA-I, apoA-II e apoA-IV),
- apo B (apoB-100 e apoB-48),
- apo C (apoC-I, apoC-II, apoC-III),
- apo E.
Também foram identificados outros tipos de apo, como apo A-V, apo H, apo J, apo L e apo M. Elas variam no tamanho e na composição química.
As apo participam, juntamente com com o colesterol, os triglicerídeos e os fosfolipídios na formação das cinco classes de lipoproteínas:
- quilomícron: contêm apo B-48
- VLDL (lipoproteína de muita baixa densidade): contêm
- apoB-100
- IDL (lipoproteína de densidade intermediária),
- LDL (lipoproteína de baixa densidade): contêm apoB-100
- HDL (lipoproteína de alta densidade): contêm apoA-I e apoA-II
Como podemos notar, certas lipoproteínas contêm proteínas B de peso molecular muito alto, que ocorrem em duas formas: a B-48, que é formada no intestino e encontrada nos quilomícrons e seus remanescentes; e a B-100, que é sintetizada no fígado e encontrada nas VLDL, remanescentes de VLDL (IDL), LDL (formadas a partir das IDL) e lipoproteínas Lp(a), formadas a partir das LDL e da proteína (a).
OBS.:
A lipoproteína(a), ou Lp(a), formada a partir das LDL e da proteína (a), pode ser encontrada em placas ateroscleróticas e contribuir para a doença coronariana ao inibir a trombólise. A Lp(a) contém uma apoproteína única, a apo(a), que possui similaridades estruturais com o plasminogênio (Ver Sistema de fibrinólise). A Lp(a) compete com, e inibe a ligação do plasminogênio ao seu receptor na célula endotelial. O plasminogênio normalmente é o substrato para o ativador de plasminogênio, que é secretado pelas células endoteliais e a estas se liga, dando origem à enzima fibrinolítica plasmina. O efeito da ligação da Lp(a) é a diminuição de formação de plasmina, inibição de fibrinólise e promoção de trombose.
As HDL consistem em, pelo menos, 20 espécies moleculares distintas, que contêm apolipoproteína A-I (apo A-I). Sabe-se que cerca de 100 outras proteínas estão distribuídas de modo variado entre as espécies de HDL.
Na Tabela abaixo, é possível observar algumas das características bioquímicas de cada lipoproteína.
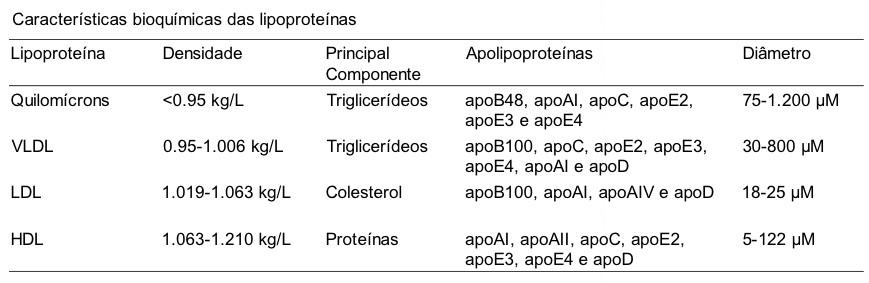
Além do tipo de apo, o percentual das apo também difere nas classes das lipoproteínas.
Quilomícrons (Qm)

Os quilomícrons (Qm) são formados no intestino e transportam na circulação os triglicerídeos (TG) de origem dietética. Além dos TG, os Qm geralmente contêm fosfolipídeos, colesterol, ésteres de colesterol e pelo menos uma vitamina lipossolúvel absorvidos pelo intestino delgado. Também contêm as apo B-48, A-I e A-IV. Após entrar na circulação sanguínea, os quilomícrons recebem das HDL as apo C-II, C-III e E. Em troca, as HDL ganham fosfolipídeos, colesterol não-esterificado e as apo A-I e A-IV.
Os quilomícrons são as maiores partículas lipoproteicas, podendo ter diâmetro de 1 mm, e as menos densas, devido à alta proporção de lipídeos (até 99%). Como toda lipoproteína, as partículas de quilomícrons são envoltas por uma monocamada de fosfolipídeos. O núcleo das partículas é composto predominantemente de TG, que constituem cerca de 85% a 90% do peso total da lipoproteína. A proporção de colesterol no quilomícron é de apenas 1% a 2%, variando com a quantidade deste lipídeo ingerido na refeição.
Metabolismo do quilomícron: o destino da gordura da dieta
Os quilomícrons recém-formados no enterócito saem para a linfa, passando daí para a circulação sistêmica através do ducto torácico. Na superfície endotelial dos capilares, ligam-se às moléculas da lipase lipoproteica ou lipoproteína lipase (LPL) através da apolipoproteína CII (apo CII). Assim, os triglicerídeos (TG) dos quilomícrons são hidrolisados até ácidos graxos livres e glicerol. Esses lipídios simples são absorvidos pelas células de tecidos periféricos como o tecido muscular e o adiposo, onde são reesterificados, formando novamente TG, que são estocados no citoplasma do tecido adiposo.
Após a ação da LPL, a partícula do quilomícron desprovida da maior parte do seu conteúdo de TG, desliga-se da molécula da enzima, voltando à corrente sanguínea. Esses catabólitos do quilomícron são designados “remanescentes de quilomícron” (proporcionalmente mais ricos em colesterol) e sofrem ação da lipase hepática (LP). Após esse processo, os remanescentes são removidos por meio da ligação da apo E com os receptores hepáticos específicos, possivelmente o receptor LDL e o receptor LRP (proteína relacionada ao receptor LDL). Remanescentes de quilomícrons e ácidos graxos são, então, capturados pelo fígado, onde são utilizados na formação de VLDL.
OBS.:
A apo E, presente na superfície dos remanescentes é a ponte de ligação entre a lipoproteína e os receptores. A apo B48, a forma de apo B encontrada nos quilomícrons, também pode ter um papel na ligação com os receptores, ainda que bem menor que o da apo E.

OBS.:
Os triglicerídeos são removidos dos tecidos extra-hepáticos por uma via compartilhada com as VLDL que envolve hidrólise pelo sistema da LPL. O diâmetro das partículas diminui à medida que ocorre depleção dos triglicerídeos. Os lipídeos de superfície e as pequenas apoproteínas são transferidos para as HDL. Os remanescentes de quilomícrons formados são captados nos hepatócitos por endocitose mediada por receptores.
VLDL e IDL
As VLDL têm composição lipídica central (parte apolar), cerca de 50% a 65% de TG e de 15% a 25% de colesterol. A porção proteica das VLDL é formada inicialmente pelas apo B-100, apo A-I e apo A-IV. Da mesma maneira que os quilomícrons, as VLDL recebem das HDL as apo C e E e, em troca, as HDL recebem as apo A-I e A-IV.
As VLDL (very low density lipoproteins) têm diâmetro de 30 a 90 nm (no máximo 1/10 do dos quilomícrons), são mais densas e com maior proporção de proteína. São sintetizadas basicamente no fígado para exportação de TG para os tecidos periféricos (transportam TG e colesterol endógenos do fígado para os tecidos). Ao passar pelos capilares (na superfície endotelial dos capilares), boa parte dos TG é hidrolisada pela enzima LPL, produzindo ácidos graxos livres para armazenamento no tecido adiposo e para oxidação em tecidos como o músculo cardíaco e o músculo esquelético.
Com a depleção de TG, a partícula fica menor, mais densa e mais rica em colesterol (o metabolismo das VLDL é semelhante ao dos quilomícrons). Também há a perda das apo C. Esta forma intermediária é conhecida como IDL (intermediate density lipoprotein), alguns dos quais sofrem endocitose diretamente nos hepatócitos. O restante é convertido em LDL pela redução adicional de triglicerídeos, em um processo mediado pela lipase hepática (LH).
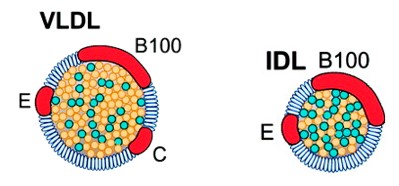
Fração proteica (apo):
- VLDL: apo B-100, apo C (apo C-I, apo C-II, apo C-III) e apo E
- IDL: apo B-100 e apo E
OBS.:
As VLDL são secretadas pelo fígado para prover os tecidos com uma fonte de TG na ausência dos quilomícrons.
LDL
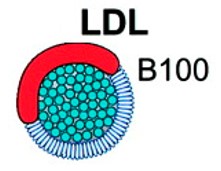
A via fundamental para a produção de LDL (low density lipoproteins) envolve a síntese de VLDL pelo fígado com a subsequente conversão de VLDL em IDL e depois em LDL por uma série de eventos envolvendo o hidrólise e remoção de triglicerídeos (TG) do núcleo das partículas. Assim, as LDL resultam da conversão das IDL por hidrólise com remoção de TG e perda de uma das apo.
As LDL são ricas em ésteres de colesterol, e são a principal forma de distribuição de colesterol aos vários tecidos, onde é necessário para síntese de membranas e hormônios. As LDL são captadas pelas células mediante receptores de membrana especiais, que a célula produz na medida de sua necessidade de importar colesterol. O que não for captado pelas células dos órgãos periféricos o será pelo fígado, onde as LDL são catabolizadas e o colesterol é reaproveitado ou excretado.
OBS.:
As principais vias de excreção do colesterol pelo corpo são: (1) conversão a ácidos biliares, sendo eliminado nas fezes, onde é formado o coprostanol (principal esterol das fezes) por ação microbiana; (2) secreção de colesterol na bile, onde é transportado ao intestino para eliminação e, (3) uma fração menor do colesterol é convertida em hormônios esteroides, sofrendo eliminação urinária.

As LDL transportam do fígado para os tecidos periféricos, cerca de 70% de todo o colesterol que circula no sangue. São pequenas e densas o suficiente para se ligarem às membranas do endotélio. Por esta razão, as LDL são as lipoproteínas responsáveis pela aterosclerose (ver O colesterol no sangue) e, por isto, denominadas “colesterol ruim” ou “mau colesterol”. Consequentemente, níveis elevados de LDL estão associados com os altos índices de doenças cardiovasculares.
Biossíntese de LDL
As LDL são catabolizadas principalmente nos hepatócitos e em outras células por meio de endocitose mediada por receptores. Os ésteres de colesterol das LDL são hidrolisados, produzindo colesterol livre para a síntese de membranas celulares. As células também obtêm o colesterol pela síntese por uma via que envolve a formação de ácido mevalônico (mevalonato) pela HMG-CoA redutase. A produção dessa enzima e dos receptores de LDL é regulada em nível de transcrição, pelo conteúdo de colesterol existente na célula. Normalmente, cerca de 70% das LDL são removidos do plasma pelos hepatócitos. O fígado recebe uma quantidade ainda maior de colesterol via IDL e quilomícrons.
HDL
As HDL (high density lipoproteins) estão envolvidas no chamado transporte reverso (dos tecidos para o fígado) do colesterol. Originam-se basicamente do fígado e intestino na forma de bicamadas discoides de fosfolipídeos, ou seja, na sua forma imatura, e são pequenos discos membranares com dupla camada de fosfolipídeos contendo colesterol e apolipoproteínas. As HDL são as menores lipoproteínas, com diâmetro da ordem de 10 nm (100 vezes menores que os quilomícrons), chegam a ter até 57% de proteínas (contra 1% dos quilomícrons) e densidade 1,210 (contra <0,95 dos quilomícrons).
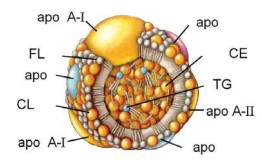
As HDL são constituídas por 50% de apolipoproteínas (apo AI em maior quantidade, apo AII, AIV, CI, CII, CIII, E, além de apo H, J, L e M), 20% de colesterol livre (CL) e de colesterol esterificado (CE), 15% de fosfolipídeos e 5% de TG.

Além das trocas dos componentes superficiais, as HDL trocam ésteres de colesterol por TG com os quilomícrons e VLDL por intermédio da CETP (proteína de transferência de ésteres de colesterol ou proteína de transferência de colesterol esterificado; do inglês cholesteryl ester transfer protein). No plasma, captam colesterol não-esterificado e o incorporam em seu centro hidrofóbico, entregando-o aos hepatócitos para catabolismo. Agem portanto como “lixeiros” de colesterol. A concentração de HDL é inversamente relacionada à incidência de aterosclerose coronária, talvez refletindo sua eficiência em remover colesterol.
OBS.:
Embora a HDL contenha TG e colesterol, sua função é muito diferente daquela dos quilomícrons e da VLDL, os quais transportam TG. A HDL troca proteínas e lipídeos com outras lipoproteínas no sangue.
Além disto, a HDL obtém colesterol livre de outras lipoproteínas e de membranas celulares e o converte em ésteres de colesterol pela reação da enzima lecitina-colesterol-aciltransferase (LCAT). Assim, a HDL tanto transporta diretamente colesterol e ésteres de colesterol para o fígado quanto transfere colesterol esterificado para outras lipoproteínas via proteína transportadora de colesterol-éster (CEPT, do inglês “cholesterol ester transfer protein”). Finalmente, partículas de HDL carregam o colesterol livre e o colesterol esterificado para o fígado, onde ocorrem a endocitose e a degradação lisossomal. Portanto, o "transporte reverso de colesterol" (isto é, o retorno do colesterol para o fígado) é a principal função da HDL.
Metabolismo e transporte do colesterol
Biossíntese do colesterol
O precursor para a síntese do colesterol é a molécula de acetilcoenzima A (acetil-CoA), a qual pode ser produzida a partir de glicose, ácidos graxos ou aminoácidos. Duas moléculas de acetil-CoA formam acetoacetil-CoA, que se condensa com outra molécula de acetil-CoA para formar hidroximetilglutaril-CoA (HMG-CoA). A redução do HMG-CoA pela enzima HMG-CoA redutase produz mevalonato (ácido mevalônico). O mevalonato produz unidades de isopreno que se condensam, formando o esqualeno. A ciclização do esqualeno produz o sistema de anel esteroide, e uma série de reações subsequentes geram o colesterol.

A maioria do colesterol endógeno é sintetizado no fígado e exportado como éster de colesterol, que é formado através da enzima lecitina-colesterol-aciltransferase (LCAT), a partir da transferência de um ácido graxo da lecitina para o colesterol, ou sob ação da acil-CoA colesterol aciltransferase (ACAT), que é uma enzima intracelular. A hidrólise dos ésteres de colesterol por uma enzima intracelular (hidrolase de ésteres de colesterol) realiza o processo inverso, convertendo ésteres de colesterol em colesterol livre. Ambas as formas são transportadas no plasma ligadas às lipoproteínas.
O fígado, seguido do intestino, são os principais locais da síntese do colesterol, podendo produzi-lo em grandes quantidades. O córtex adrenal e as gônadas (testículos e ovários) também sintetizam colesterol em quantidades significativas e o utilizam como um precursor para a síntese de hormônios esteroides.
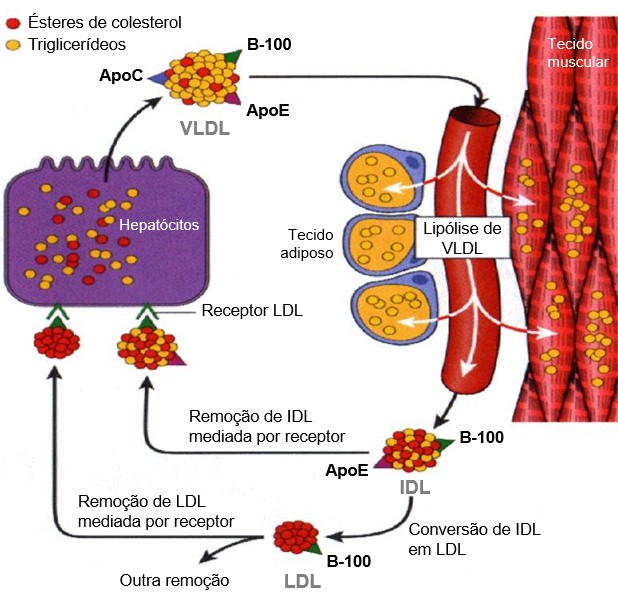
Relembrando, o colesterol exógeno (proveniente da dieta) é empacotado em quilomícrons no intestino e o colesterol endógeno, em VLDL no fígado. Ele é transportado no sangue nessas partículas de lipoproteínas, as quais também transportam TG. Quando os TG das lipoproteínas do sangue são hidrolisados pela LPL, os quilomícrons são convertidos em quilomícrons remanescentes, e a VLDL é convertida em IDL e, subsequentemente, em LDL. Esses produtos retornam ao fígado, onde se ligam a receptores nas membranas das células e são captados por endocitose e digeridos por enzimas lisossomais. O LDL também sofre endocitose nos tecidos não-hepáticos (periféricos). O colesterol e outros produtos da digestão lisossomal são liberados dentro das células. O fígado usa esse colesterol reciclado e o colesterol que é sintetizado a partir do acetil-CoA, para produzir VLDL e para sintetizar os sais biliares.
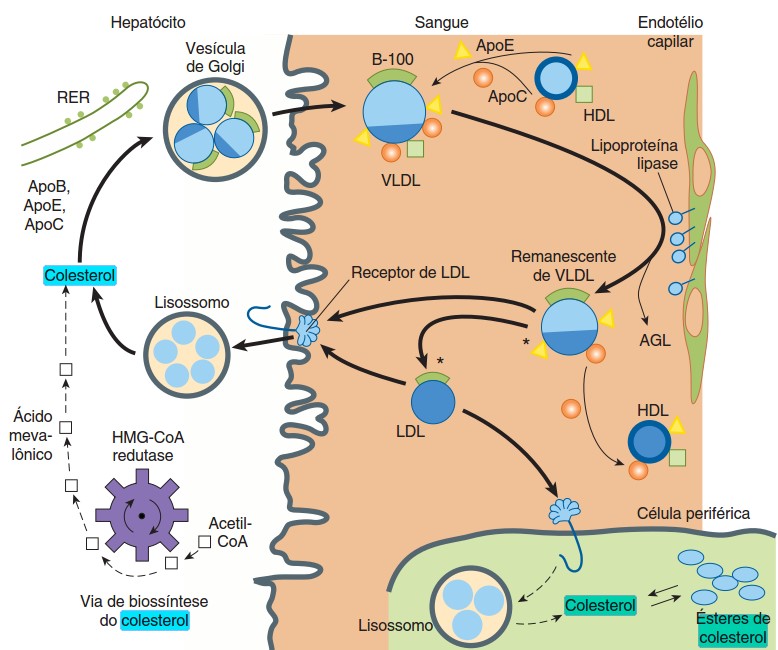
Transporte de colesterol
O colesterol proveniente da dieta, chega ao fígado a partir de quilomícrons remanescentes e daí provoca a inibição da síntese da enzima da HMG-CoA redutase, diminuindo com isto a síntese endógena.
O transporte de colesterol endógeno (via endógena) é semelhante ao previamente apresentado para o colesterol proveniente da dieta (via exógena), com algumas diferenças. Além da ausência dos quilomícrons na via endógena (o transporte de lipídeos de origem hepática ocorre por meio das VLDL, IDL e LDL), a montagem das partículas de VLDL no fígado pela via endógena requer a ação de uma proteína intracelular, a chamada proteína de transferência de TG microssomal (MTP, do inglês microsomal triglyceride transfer protein), responsável pela transferência dos TG para a apo B, permitindo a formação da VLDL.
Já́ na circulação, os TG das VLDL, assim como no caso dos quilomícrons, são então hidrolisados pela LPL, enzima estimulada pela ApoC-II e inibida pela ApoC-III. Os ácidos graxos assim liberados são redistribuídos para os tecidos, onde podem ser armazenados (como no tecido adiposo) ou prontamente utilizados (como nos músculos). Por ação da LPL, as VLDL progressivamente são depletadas de TG, transformam-se em remanescentes, os quais são removidos pelo fígado por receptores específicos. Uma parte das VLDL dá origem às IDL, que continuam no processo catabólico [que inclui a ação da lipase hepática (LH)], resultando na formação das LDL.
Ou seja, a partir do ponto em que a VLDL vai para a circulação, ambos os transportes são idênticos. Resumidamente, os transportes em ambas as vias são apresentados a seguir.
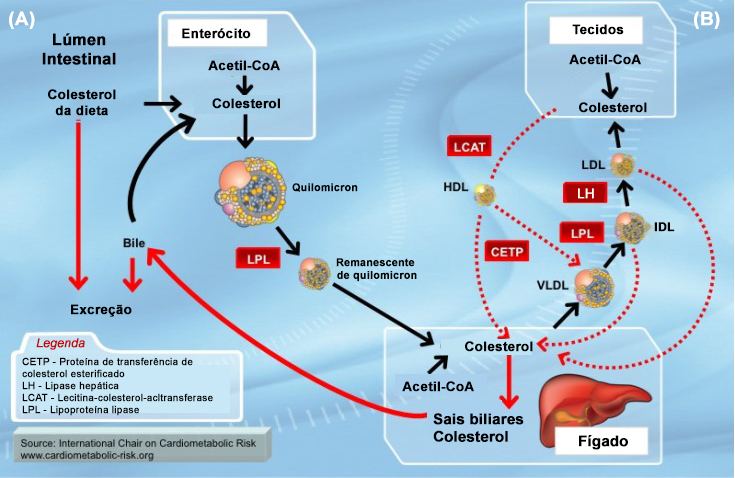
Na via exógena, após serem absorvidas pelas células intestinais do íleo, as diversas partículas lipídicas são utilizadas na produção de quilomícrons, que são transportados na linfa e depois no sangue para os capilares dos tecidos periféricos (principalmente músculos e tecido adiposo). Os TG são hidrolisados pela LPL e os tecidos captam os ácidos graxos livres e o glicerol resultantes. Os quilomícrons remanescentes, ainda contendo seu complemento de ésteres de colesterol, passam para o fígado através da ligação a receptores presentes nos hepatócitos e endocitose. O colesterol liberado dentro dos hepatócitos é armazenado, oxidado a ácidos biliares, secretado inalterado na bile, ou pode ingressar na via endógena.
Em indivíduos normais, aproximadamente metade das IDL retornam ao fígado, através dos receptores LDL, por endocitose (LDL e IDL contêm apoproteínas que se ligam especificamente aos receptores LDL – aproximadamente 1.500 receptores por célula), e os IDL são convertidos em LDL por uma série de eventos sequenciais envolvendo o hidrólise e remoção de TG do núcleo das partículas.

OBS.:
As remanescentes de VLDL, as IDL e as LDL levam o colesterol de volta para o fígado, onde se ligam a receptores nas membranas das células e são captados por endocitose e digeridos por enzimas lisossomais. O colesterol liberado é ressintetizado a éster de colesterol dentro da célula hepática e pode inibir a produção da HMG-CoA redutase dentro de poucas horas, diminuindo com isto, a síntese do colesterol intracelular (endógeno).
As células dos tecidos periféricos também captam a LDL por endocitose, através dos receptores de LDL que reconhecem a apo B-100.
Na via endógena, o transporte de lipídeos de origem hepática ocorre por meio das VLDL, IDL e LDL. O colesterol e os TG recém-sintetizados pelos hepatócitos são transportados do fígado na forma de VLDL para os tecidos periféricos. O restante segue igual à via exógena ou intestinal. Resumidamente, os TG são hidrolisados pela LPL e os tecidos captam os ácidos graxos livres e o glicerol resultantes. Por ação da LPL, as VLDL são progressivamente depletadas de TG, transformando-se em remanescentes, que são removidos pelo fígado por receptores específicos. Uma parte das VLDL dá origem às IDL. O processo de catabolismo continua e inclui a ação da lipase hepática, resultando na formação das LDL (as partículas lipoproteicas tornam-se menores, porém retêm um complemento total de ésteres de colesterol e se tornam partículas LDL, como na via exógena ou hepática).
OBS.:
A LDL, além de fornecer a fonte de colesterol para incorporação em membranas celulares e para a síntese de esteroides, é também é essencial para a aterogênese.
Dos tecidos (em ambas as vias), o colesterol pode retornar ao plasma na forma de partículas HDL (transporte reverso de colesterol). O colesterol é esterificado com ácidos graxos de cadeia longa em partículas HDL, e os ésteres de colesterol resultantes são transferidos para partículas VLDL ou LDL através da proteína de transferência de colesterol esterificado (CETP, do inglês, cholesteryl ester transfer protein), uma proteína de transferência presente no plasma.
OBS.:
Antes de deixar os hepatócitos, o colesterol incorpora-se nas VLDL. Estas, na corrente sanguínea, recebem as apoproteínas E e C-II das HDL e, ao passar pelos capilares dos tecidos periféricos, são transformadas em IDL e depois em LDL.
As HDL são responsáveis pela recuperação do colesterol livre depositado na superfície da membrana das células periféricas. Elas prendem esse colesterol esterificando-o e levando-o de volta para o fígado, onde ocorrem a endocitose e a degradação lisossomal, o que o remove da circulação. O fígado remove da circulação as HDL que cumpriram sua missão; ele as internaliza e hidrolisa seus ésteres de colesterol, que entrarão na composição de novas lipoproteínas.
Atualmente, existe interesse nas quatro proteínas de transferência de lipídeos que foram associadas à aterogênese:
- ACAT (acil-CoA colesterol aciltransferase): catalisa a síntese intracelular de éster de colesterol em macrófagos, córtex da suprarrenal, intestino e fígado.
- LCAT (lecitina-colesterol-aciltransferase): catalisa a síntese de éster de colesterol em partículas HDL.
- CETP (proteína de transferência de colesterol esterificado) e PLTP (proteína de transferência de fosfolipídios): envolvidas na transferência de colesterol entre diferentes classes de partículas de lipoproteína no plasma.
O colesterol no sangue
Primeiramente, vamos relembrar a aterogênese, que envolve os seguintes processos:
1. A disfunção endotelial, com alteração na biossíntese de óxido nítrico (NO), predispõe à aterosclerose.
2. A lesão do endotélio disfuncional leva à expressão de moléculas de adesão. Isto promove a fixação e a migração de monócitos da luz para a íntima. As lesões têm predileção por regiões com distúrbios de fluxo, como os pontos de origem dos ramos aórticos.
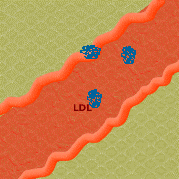
3. O colesterol forma um complexo com a LDL e é transportado para a parede do vaso.
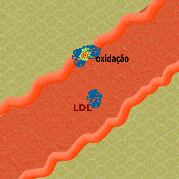
4. As células endoteliais e monócitos/macrófagos geram radicais livres que oxidam o LDL (oxLDL), resultando em peroxidação lipídica.

5. O oxLDL é captado por macrófagos através de receptores "depuradores" (scavenger). Tais macrófagos são chamados de células espumosas em razão do seu aspecto histológico "espumoso", decorrente do acúmulo de lipídeos no citoplasma, e são característicos de ateroma. A captação de oxLDL ativa os macrófagos e libera citocinas pró-inflamatórias.
6. Coleções subendoteliais de células espumosas e de linfócitos T formam estrias gordurosas.
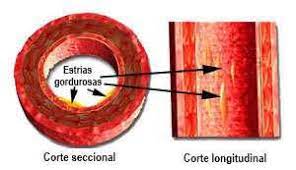
7. O colesterol pode ser mobilizado da parede da artéria e transportado no plasma sob a forma de colesterol com lipoproteína de alta densidade (HDL), um mecanismo protetor denominado "transporte reverso de colesterol".

8. Plaquetas, macrófagos e células endoteliais ativados liberam citocinas e fatores de crescimento, causando proliferação de musculatura lisa e deposição de componentes do tecido conjuntivo. Esta resposta inflamatória fibroproliferativa leva a uma densa capa fibrosa sobre um centro rico em lipídeos, e essa estrutura inteira compõe a placa ateromatosa. Pode ocorrer uma lenta deposição de cálcio, numa tentativa de isolar a área afetada.

9. A placa pode romper-se, formando um substrato para trombose. A presença de grande número de macrófagos predispõe à ruptura da placa, enquanto o músculo liso vascular e as proteínas da matriz estabilizam a placa.
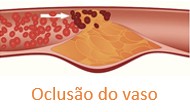
Podemos perceber que níveis elevados de colesterol no sangue, particularmente das LDL, estão associados à formação de placas ateroscleróticas que podem ocluir os vasos sanguíneos e causar infarto do miocárdio (IAM), acidente vascular cerebral (AVC) ou doença vascular periférica.
De fato, a aterosclerose é fortemente determinada pela presença aumentada da LDL, cujo principal componente é o colesterol e que tem como função transportá-lo para os tecidos periféricos. Tem-se, consistentemente, demonstrado que, quanto maior o valor de LDL, maior o risco de aterosclerose. Inversamente relacionada com a aterosclerose está a HDL, cujo componente também é o colesterol e que tem como função transportá-lo dos tecidos periféricos para o fígado, para ser metabolizado ou excretado. Assim, quanto maior a HDL, menor a chance de formação da placa aterosclerótica.
Dislipidemia é o termo utilizado para designar os níveis alterados (aumentados) de lipídeos e/ou lipoproteínas por meio da alteração em alguma ou algumas das fases do metabolismo lipídico.
A determinação do perfil lipídico no jejum é utilizada para discriminar indivíduos com risco de aterosclerose. Apesar de fornecer dados importantes, devemos lembrar que o jejum é um estado passageiro, e que permanecemos a maior parte do dia no período pós-prandial. A hiperlipidemia pós-prandial está associada à aterosclerose e é exacerbada pela hipertrigliceridemia.
OBS.:
As 12 horas de jejum para a determinação do perfil lipídico já não são mais obrigatórias e os laboratórios poderão realizar a coleta do sangue independentemente do tempo que o paciente alimentou-se pela última vez. O médico que solicitar o exame poderá estabelecer o tempo de jejum do seu paciente.
Os valores de referência para o perfil lipídico são apresentados na Tabela abaixo.
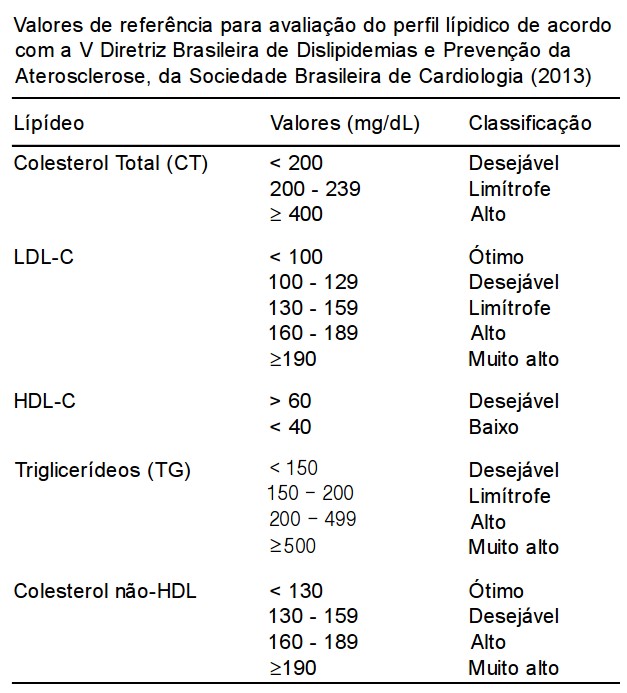
OBS.:
Se a pessoa já manifestou eventos como infarto do miocárdio, cirurgia de revascularização, angioplastia ou fez coronariografia (cateterismo cardíaco), o LDL precisa ficar abaixo de 130. Se existem fatores de risco associados como diabetes, hipertensão e fumo, deve ficar abaixo de 100.
Controle da Gordura Corporal
Quando o valor calórico dos alimentos ingeridos em um determinado tempo supera o total da energia consumida no mesmo período, os alimentos excedentes são convertidos em gorduras corporais. Essa conversão acontece mais facilmente quando ingerimos gorduras do que quando ingerimos proteínas ou carboidratos.
Enquanto houver glicose disponível, ela será usada, e o metabolismo das gorduras será interrompido. O estoque de glicose é representado pelo glicogênio, armazenado no fígado e nos músculos. Em um adulto em jejum, o estoque de glicogênio esgota-se dentro de 12 a 24 horas. A seguir, são consumidas as reservas de gordura e, se necessário, as de proteína, posteriormente. As células podem usar até 50% de suas proteínas como fonte de energia, antes que ocorra morte celular.
Controle do colesterol
Coma mais frutas e vegetais.
Aumente a ingestão de alimentos ricos em fibras. Ex.: legumes, verduras, cereais, pães integrais etc.
Coma mais peixe grelhado ou assado, carne de aves sem pele e reduza o consumo de carne vermelha (dê preferência para cortes magros).
Evite frituras.
Limite a ingestão de gorduras saturadas. Ex.: manteiga e gorduras de origem animal.
Dê preferência a queijos brancos e utilize derivados de leite pobres em gordura. Ex.: leite desnatado, iogurte desnatado e sorvetes light.
Faça exercícios físicos regularmente.
Elimine ou reduza o cigarro.
Controle doenças como diabetes e hipertensão arterial.
Emagreça e mantenha o índice de massa corporal (IMC) até no máximo 25. O calculo é simples, basta dividir o seu peso pela sua altura ao quadrado. Ex.: peso = 70 kg; altura = 1,70 m
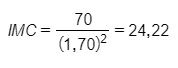
Condição | IMC |
| abaixo do peso | abaixo de 18,5 |
| peso normal | entre 18,5 e 24,9 |
| sobrepeso | entre 25 e 29,9 |
| obesidade I (leve) | entre 30,0 e 34,9 |
| obesidade II (moderada) | entre 35,0 e 39,9 |
| obesidade III (extrema) | igual ou superior a 40 |
Aterosclerose e receptores de LDL
Para algumas pessoas, exercícios e dieta NÃO são suficientes para diminuir o nível de colesterol. Elas sofrem de uma doença genética denominada hipercolesterolemia familiar. Estudos indicam que existe um defeito na capacidade das LDL de se ligarem aos receptores, e não há inibição por “feedback” da síntese de colesterol. Sabe-se que na forma grave da doença, os níveis sanguíneos de colesterol frequentemente excedem 700 mg/dL, o que provoca deposição excessiva de colesterol na parede das artérias. As manifestações clínicas incluem nível elevado de LDL (colesterol “ruim”) no plasma, depósitos nos tendões, pele (xantomas) e artérias, e, dependendo do caso, podem ocorrer na infância, o que é geralmente fatal.
Esse é um dos vários motivos pelos quais a indústria farmacêutica investe milhões de dólares na pesquisa de fármacos capazes de reduzir o nível de colesterol.
Algumas armas químicas contra o colesterol
A decisão quanto ao uso de terapia farmacológica para a hiperlipidemia baseia-se no defeito metabólico específico e no seu potencial de causar aterosclerose ou pancreatite. A dieta deve ser mantida para a obtenção de todo o potencial do esquema farmacológico.
Existem vários tipos de fármacos para o tratamento da hipercolesterolemia. Alguns deles são destacados abaixo.
Inibidores competitivos da HMG-CoA redutase: Esses compostos são análogos estruturais da HMG-CoA. Agem inibindo uma das etapas na biossíntese do colesterol; também aumentam o número de sítios receptores de LDL no fígado. A lovastatina, a atorvastatina, a fluvastatina, a pravastatina, a sinvastatina, a rosuvastatina e a pitavastatina pertencem a essa classe. Esses fármacos são mais efetivos na redução dos níveis de LDL. Outros efeitos observados incluem diminuição do estresse oxidativo e da inflamação vascular, com aumento da estabilidade das lesões ateroscleróticas. Tornou-se padrão iniciar a terapia com a redutase de imediato após a ocorrência de síndromes coronarianas agudas, independentemente dos níveis de lipídeos.
Misturas de fibras e proteínas (fibratos): conduzem ao aumento do catabolismo do colesterol com o objetivo de repor a perda de sais biliares. O consequente decréscimo do nível sérico de LDL induz à síntese de receptores LDL (exceto na hipercolesterolemia familiar). Infelizmente, a queda do colesterol plasmático também induz a síntese da enzima HMG-CoA redutase, a qual eleva a biossíntese do colesterol, resultando numa queda de apenas 15 a 20% do nível sérico do lipídeo. A genfibrozila e o fenofibrato diminuem os níveis de VLDL e, em alguns pacientes, de LDL também.
Resinas de ligação de ácidos biliares (sequestradores de ácido biliar): administração de resinas que se ligam aos ácidos biliares. Reduzem a reabsorção dos ácidos biliares e assim mais colesterol do fígado e das LDL é desviado para produzir os ácidos biliares. Dessa maneira, diminuem a concentração de colesterol em 15-20%, por promoverem a conversão de parte do colesterol plasmático em ácidos biliares. O colestipol, a colestiramina e o colesevelam mostram-se úteis apenas em casos de elevações isoladas da LDL. Em pacientes que apresentam hipertrigliceridemia, os níveis de VLDL podem aumentar ainda mais durante o tratamento com resinas.
Niacina (ácido nicotínico): também conhecida com vitamina B3, esta vitamina é capaz de diminuir a concentração de VLDL; o que acaba por reduzir a concentração de LDL e aumentar a concentração de HDL. A niacina (mas não a niacinamida) diminui os níveis de triglicerídeos e LDL, bem como de Lp(a), na maioria dos pacientes.
Inibidores da absorção intestinal de esteróis: A ezetimiba inibe a absorção intestinal de fitoesteróis e do colesterol. Seu principal efeito clínico consiste em redução dos níveis de LDL.
Além desses, existem ainda os inibidores antissentido da síntese de apo B-100 (mipomerseno), inibidores da CETP (torcetrapibe, anacetrapide, evacetrapibe), entre outros.
A terapia com associação de fármacos também mostra-se útil quando:
- (1) os níveis de VLDL estão significativamente elevados durante o tratamento da hipercolesterolemia com resina;
- (2) os níveis de LDL e VLDL estão elevados a princípio;
- (3) os níveis de LDL ou VLDL não se normalizam com a administração de um único fármaco;
- (4) observa-se a coexistência de níveis elevados de Lp(a) ou de deficiência de HDL com outras hiperlipidemias.
O que fazer na dieta
Substituição de ácidos graxos saturados por ácidos graxos poliinsaturados (ex.: ácido linoleico): são mais rapidamente metabolizados no fígado, diminuindo a concentração de colesterol plasmático.
Portanto, concluímos que o uso combinado de medicamentos e dieta poderá resultar numa queda plasmática do colesterol de 50 a 60%, de um histórico familiar de hipercolesterolemia; alerta a necessidade de instituir o tratamento desde a infância do indivíduo como conduta preventiva indispensável.
Para maiores informações, consulte:
- BETTEMBOURG, C. 2013. Semantic methods for the cross-species metabolic pathways comparison: application to human, mice and chicken lipid metabolism.
- DOS SANTOS FILHO, R.D.; MARANHÃO, R.C. Hipertrigliceridemia e dislipidemia pós-prandial. HiperAtivo 1999; 2: 152-157.
- DOS SANTOS, A.P.C.; CASTILHO, M.S.; DOS SANTOS, R.; COUTO, R.D. Proteína de Transferência de Colesterol Esterificado (CETP): potencial dos inibidores de CETP na redução da incidência de doenças cardiovasculares associadas à hipertrigliceridemia e baixos níveis do HDL-C. Rev Ci Med Biol (Salvador) 2011; 10(2): 187-193.
- FORTI, N.; DIAMENT, J. Apolipoproteínas B e A-I: fatores de risco cardiovascular? Rev Assoc Med Bras 2007; 53(3): 276-82.
- FORTI, N.; DIAMENT, J. Lipoproteínas de Alta Densidade: Aspectos metabólicos, clínicos, epidemiológicos e de intervenção terapêutica. Atualização para os clínicos. Arq Bras Cardiol 2006; 87: 672-679.
- GONDIM, T.M.; DE MORAES, L.E.P.; FEHLBERG, I.; BRITO, V.S. Aspectos fisiopatológicos da dislipidemia aterogênica e impactos na homeostasia. RBAC 2017; 49(2):120-126.
- INEU, M.L.; MANENTI, E.; DA COSTA, J.L.V.; MORIGUCHI, E. Manejo da HDL: avanços recentes e perspectivas além da redução de LDL. Arq Bras Cardiol 2006; 87(6): 788-794.
- LEANÇA, C.C.; PASSARELLI, M.; NAKANDAKARE, E.R.; QUINTÃO, E.C.R. HDL: o yin-yang da doença cardiovascular. Arq Bras Endocrinol Metab 54 (9): 777-784.
- LUDKE, M.C.M.M.; LÓPEZ, J. Colesterol e composição dos ácidos graxos nas dietas para humanos e na carcaça suína. Cienc Rural 1999; 29 (1): 181-187.
- MARANHÃO, R.C. Metabolismo dos quilomícrons e risco de desenvolvimento de doença arterial coronária. Atheros 2002; 13(3): 73-76.
- NOVAK, E.M.; BYDLOWSKI, S.P. Biologia Molecular das Dislipidemias. Variação Genética das Apolipoproteínas. Arq Bras Cardiol 1996; 67(6): 411-417.
- SALDANHA, A.L.R.; SCARTEZINI, M.; MARGEOTTO, A.P.P.; PEREIRA, A.; GASPAROTO, A.L.V.; MARTINEZ, T.L.R. Lipoprotein metabolism with a focus on COVID 19 kidney patients. Int J Family Community Med 2020; 4(5): 123- 127.
- SOCIEDADE BRASILEIRA DE CARDIOLOGIA. Atualização da Diretriz Brasileira de Dislipidemias e Prevenção da Aterosclerose 2017. Disponível em: <http://publicacoes.cardiol.br/2014/diretrizes/2017/02_DIRETRIZ_DE_DISLIPIDEMIAS.pdf> Acesso em 22/06/2021.
Veja também:
- Colesterol alto: por que pode fazer diferença olhar para os genes.
- Colesterol é essencial, mas em excesso traz riscos; veja o que eleva a taxa.
- Colesterol ruim: duas injeções anuais reduzem os níveis pela metade.
- Sem Frescura: por que tem colesterol bom e ruim? E o que causa no corpo?
- O que você precisa saber sobre o colesterol.
- Triglicerídeos alterados: quando e por que devo me preocupar?
