Coagulação sanguínea (hemostasia)
A coagulação sanguínea é um processo dinâmico com o intuito de manter a homeostase circulatória. Quando a parede de um vaso sanguíneo é lesada, inicia-se um processo denominado hemostasia, que visa impedir a perda de sangue (hemorragia). A hemostasia é um fenômeno complexo que envolve a musculatura lisa do vaso lesado, as plaquetas e diversos fatores do plasma sanguíneo que promovem a coagulação do sangue. A contração do músculo liso é estimulada pela serotonina liberada pelas plaquetas.
Em um indivíduo normal, a coagulação é iniciada após ocorrer lesão em um vaso sanguíneo, causando danos às células endoteliais. As plaquetas formam imediatamente um tampão plaquetário no local da lesão. Essa é a chamada hemostasia primária (o endotélio vascular e as plaquetas são os componentes da hemostasia primária). A hemostasia secundária acontece quando proteases plasmáticas, chamadas fatores de coagulação, respondem, em uma complexa cascata de reações químicas, para formar uma rede de fibrina, que fortalece o tampão plaquetário.
Mecanismos da hemostasia
Os componentes do sistema hemostático incluem os vasos sanguíneos, as plaquetas, as proteínas da coagulação do sangue (responsáveis pela formação do coágulo de fibrina), os anticoagulantes naturais e o sistema de fibrinólise (responsável pela dissolução do coágulo de fibrina). Resumidamente, os passos são os seguintes:
Resumidamente, os passos são os seguintes:
(1) espasmo vascular: imediatamente após a ruptura ou o corte de um vaso sanguíneo ocorre vasoconstrição (contração) do vaso sanguíneo lesado.
(2) formação de tampão plaquetário: acúmulo de plaquetas para formar um tampão plaquetário no vaso lesado:
- adesividade das plaquetas no local da lesão
- aderência das plaquetas entre si
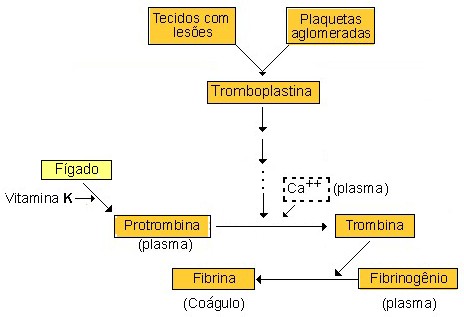
(3) coagulação sanguínea: sequência complexa de reações químicas em cascata que resultam na formação de um coágulo de fibrina. Abreviadamente, substâncias ativadoras provenientes tanto da parede vascular traumatizada e das plaquetas (entre elas, a enzima tromboplastina) dão início a uma complexa rede de reações químicas em cascata (ou em cadeia) que, na presença de íons cálcio, culmina na conversão da proteína plasmática protrombina em enzima ativa trombina. A trombina, por sua vez, converte o fibrinogênio em fibrina, que forma uma rede de filamentos que retém plaquetas, células sanguíneas e plasma, formando o coágulo.
(4) regeneração: crescimento de tecidos fibrosos no coágulo sanguíneo para obturar o orifício do vaso.
OBS.:
- A lesão do endotélio do vaso sanguíneo expõe o sangue ao contato com o colágeno da região subendotelial, o que por si só promove a adesão das plaquetas na presença do fator von Willebrand. Quando isto ocorre, as plaquetas tornam-se ativadas e liberam o conteúdo dos grânulos citoplasmáticos. As plaquetas, graças à sua capacidade de adesão às superfícies não-endoteliais e de aglutinação mútua, chegam a formar verdadeiras rolhas hemostáticas.
- A síntese de alguns fatores de coagulação (como protrombina) ocorre no fígado e é dependente de vitamina K, cuja deficiência pode provocar hemorragias. De forma semelhante, para a conversão de protrombina em trombina é necessária a presença de íons cálcio. Consequentemente, a falta de vitamina K e/ou de cálcio pode comprometer a coagulação sanguínea, resultando em tendência a hemorragias.
- Os fatores de coagulação do sangue são, em sua maioria, formas inativas de enzimas proteolíticas. Quando convertidas nas suas formas ativas, suas reações enzimáticas causam as sucessivas reações em cascata do processo de coagulação.
Participação das plaquetas na coagulação do sangue
A coagulação sanguínea inicia-se através das plaquetas que se aderem e que são ativadas pelo colágeno do endotélio do vaso sanguíneo, que fica exposto quando o vaso é lesado. As plaquetas ativadas então liberam o conteúdo de seus grânulos, que contém uma grande variedade de substâncias que estimulam uma ativação ainda maior de outras plaquetas e melhoram o processo hemostásico.
A participação das plaquetas na coagulação do sangue pode ser resumida da seguinte maneira:
- Agregação primária: descontinuidades do endotélio produzidas por lesão vascular são seguidas pela absorção de proteínas do plasma sobre o colágeno adjacente. As plaquetas também aderem ao colágeno, formando um tampão plaquetário.
- Agregação secundária: as plaquetas do tampão liberam ADP, que é um potente indutor da agregação plaquetária, fazendo aumentar o número de plaquetas do tampão.
- Coagulação do sangue: durante a agregação das plaquetas, fatores do plasma sanguíneo, dos vasos lesionados e das plaquetas promovem a interação sequencial (em cascata) de cerca de 16 proteínas plasmáticas, dando origem a um polímero, a fibrina, e formando uma rede fibrosa tridimensional, que aprisiona eritrócitos, leucócitos e plaquetas. Forma-se assim o coágulo sanguíneo, mais consistente e firme do que o tampão plaquetário.
Um defeito hereditário na formação de uma das proteínas do plasma (fatores VIII ou IX) resulta na doença hemorrágica conhecida como hemofilia. Pessoas com hemofilia tipo A são deficientes de fator VIII (oito). Já as pessoas com hemofilia do tipo B são deficientes de fator IX (nove). Os sangramentos são iguais nos dois tipos, porém a gravidade dos sangramentos depende da quantidade de fator presente no plasma.
- Retração do coágulo: inicialmente o coágulo provoca grande saliência para o interior do vaso, mas logo se contrai, graças à ação da actina, miosina e ATP das plaquetas.
- Remoção do coágulo: protegida pelo coágulo, a parede do vaso se restaura pela formação de tecido novo. Então o coágulo é removido principalmente pela enzima plasmina, formada pela ativação da proenzima plasmática plasminogênio pelos ativadores do plasminogênio produzidos pelo endotélio. Enzimas liberadas pelos lisossomos das plaquetas também contribuem para a remoção do coágulo.
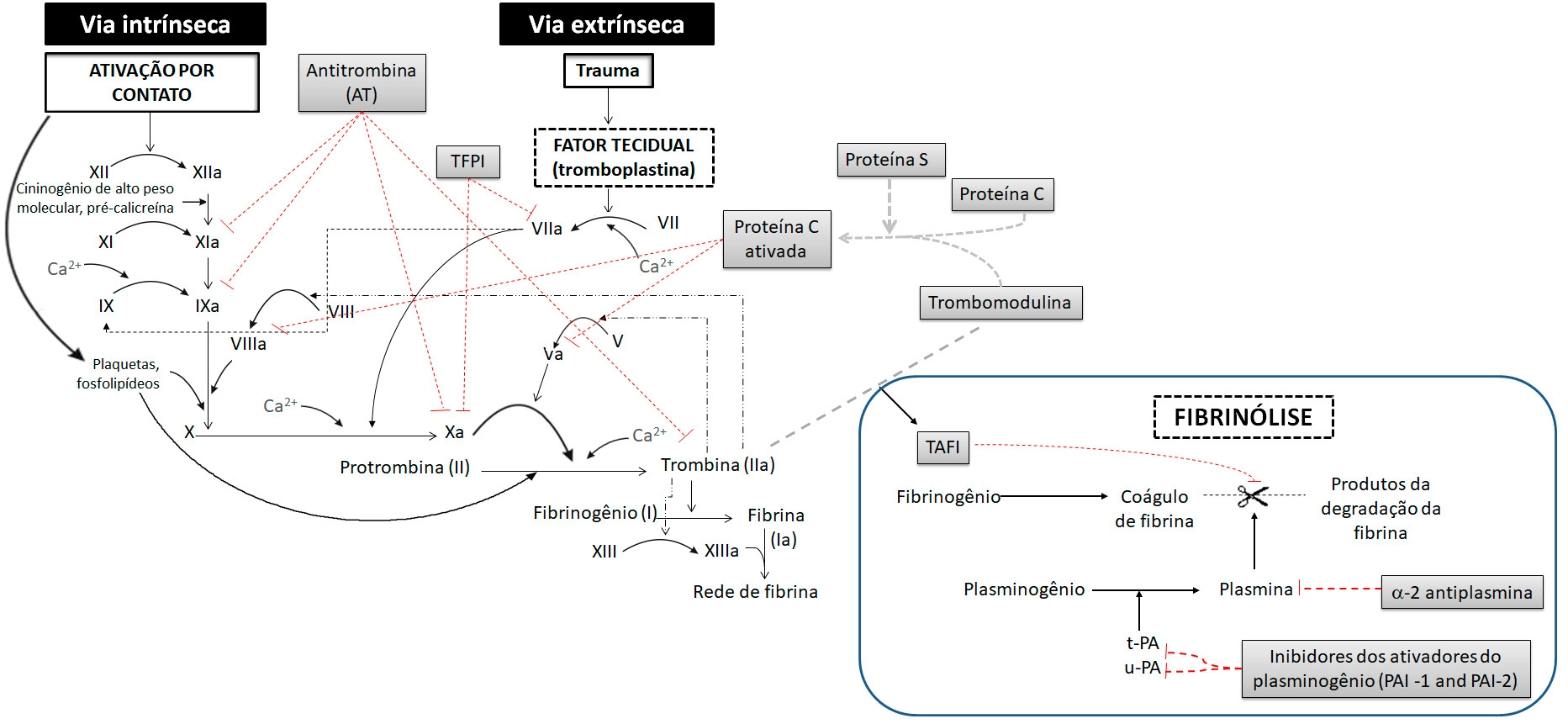
Cascata de coagulação sanguínea
O sistema de coagulação do sangue envolve complexas interações entre proteases plasmáticas (conhecidas como fatores de coagulação sanguínea) e seus cofatores, onde os precursores inativos são ativados em série (ou em cascata), cada precursor dando origem a uma quantidade maior do próximo, e culminando na formação da enzima trombina que, por proteólise, converte o fibrinogênio solúvel em uma malha de fibrina insolúvel e resistente, que reforça o tampão plaquetário e pára o sangramento até que ocorra reparo.
A clássica cascata da coagulação foi introduzida em 1964(*). Neste modelo a ativação de cada fator de coagulação leva à ativação de outro fator até a formação da trombina. Esses fatores foram numerados de I ao XIII. O número correspondente para cada fator foi designado considerando a ordem de sua descoberta e não do ponto de interação com a cascata. O fator VI, que foi utilizado para designar um produto intermediário na formação da tromboplastina não possui mais qualquer designação (não existe). O fator III é a tromboplastina tecidual, chamada atualmente de fator tecidual ou tissular (TF). O fator IV é utilizado para designar o cálcio iônico (Ca2+), que deve ser mantido na concentração sérica acima de 0,9 mM/L para a otimização da formação do coágulo.
(*)MACFARLANE, R.G. An enzyme cascade in the blood clotting mechanism, and its function as a biochemical amplifier. Nature 1964; 202: 498-499; DAVIE, E.W.; RATNOFF, O.D. Waterfall sequence for intrinsic blood clotting. Science 1964; 145(3638):1310-1312.
O modelo da cascata dividiu a sequência da coagulação em duas vias: (1) a via intrínseca (ou via de ativação por contato), na qual todos os componentes estão presentes no plasma sanguíneo; e (2) a via extrínseca (ou via do fator tecidual), na qual é necessária não só a presença de componentes do plasma, mas também do fator tecidual (FT) ou tromboplastina, que é uma proteína transmembranar não expressa constitutivamente nas células endoteliais, mas presente nas membranas das células ao redor do leito vascular, como células do músculo liso e fibroblastos (e que é lançado no sangue após lesão).
Os eventos comuns da coagulação (via final comum), quer sejam iniciados pela via intrínseca ou extrínseca, são a ativação do fator X, a conversão de trombina a partir da protrombina pela ação do fator X ativado (Xa), formação de fibrina estimulada pela trombina e estabilização da fibrina pelo fator XIIIa (fator XIII ativado).
O esquema a seguir apresenta as duas vias, que convergem no ponto de ativação do fator X (“via final comum”), desencadeando a geração de trombina e subsequente formação de fibrina.
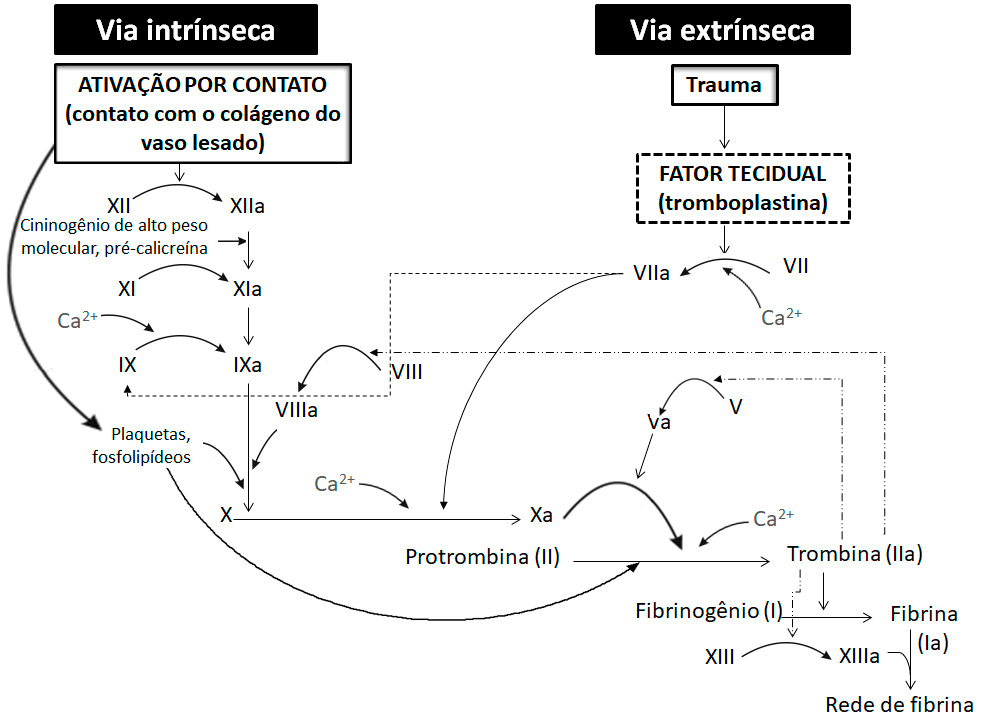
A coagulação, pela via intrínseca, é desencadeada quando o fator XII é ativado (XIIa) pelo contato com alguma superfície carregada negativamente (por exemplo, colágeno do vaso lesado). O fator XIIa (fator XII ativado) ativa o fator XI, que, por sua vez, ativa o fator IX. O fator IXa (fator IX ativado), na presença de fator VIIIa (fator VIII ativado), ativa o fator X da coagulação, desencadeando a geração de trombina e subsequente formação de fibrina.
Para ativar o fator XI, são necessários, além do fator XII, a pré-calicreína e o cininogênio de alto peso molecular (HMWK = high molecular weight Kininogen). Tanto o fator XI quanto a pré-calicreína necessitam do HMWK para efetuar a adsorção à superfície em que está ligado o fator XIIa (fator XII ativado). Da interação destes elementos é ativado o fator XI (fator XIa), que transforma o fator IX em IXa (fator IX ativado). O fator IXa e o fator VIIIa associam-se à superfície de fosfolipídio através de uma "ponte" de cálcio estimulando a conversão de fator X para Xa.
De modo mais simples, na via extrínseca, a coagulação é desencadeada quando os tecidos lesados liberam o fator tecidual (FT ou tromboplastina tecidual) no sangue, o qual forma um complexo com o fator VII, ativando-o. Este complexo (VIIa/FT) tem como substratos principais o fator IX e o fator X, cuja clivagem resulta na ativação de ambos. A partir da ativação do fator X, as duas vias encontram um caminho comum em que ocorre a conversão de protrombina (fator II) em trombina (fator IIa) que, por sua vez, estimula a transformação de fibrinogênio (fator I) em fibrina (fator Ia).
Postulou-se no passado, pela gravidade das manifestações hemorrágicas decorrentes das deficiências dos “fatores intrínsecos” VIII e IX (hemofilia A e B, respectivamente), que a via intrínseca teria maior relevância na fisiologia da coagulação. Entretanto, esta ideia foi demonstrada ao longo do tempo como sendo incorreta: sabe-se hoje que deficiências dos fatores da ativação por contato (fator XII, pré-calicreína, cininogênio de alto peso molecular) não resultam em quadro hemorrágico e que a deficiência de fator XI está associada a distúrbio hemorrágico leve. Os fatores intrínsecos, portanto, não têm importância primária na geração de fator Xa durante o processo hemostático normal que sucede a injúria vascular.
Por outro lado, a deficiência de fator VII (crucial para a “ativação extrínseca” da coagulação do sangue) está associada a quadro hemorrágico similar ao da hemofilia. Em conjunto, esses dados demonstram que a ativação do fator IX não depende exclusivamente da via intrínseca e indicam que a coagulação do sangue é iniciada principalmente pela via do fator tecidual ou extrínseca. Adicionalmente, experimentos conduzidos nas últimas décadas demonstraram que as vias intrínseca e extrínseca não exibem funcionamento independente. Atualmente, aceita-se que mecanismos hemostáticos fisiologicamente relevantes estejam associados com três complexos enzimáticos pró-coagulantes, os quais envolvem as proteases plasmáticas (fatores de coagulação) dependentes de vitamina K (fatores II, VII, IX e X) associadas a cofatores (V e VIII), todos localizados em uma superfície de membrana contendo fosfolipídeos.
OBS.:
- A ativação do fator XII não é indispensável para a hemostasia, uma vez que pacientes com deficiência de fator XII ou cininogênio de alto peso molecular (HMWK) não apresentam sangramento anormal. A deficiência de fator XI está associada a diversos distúrbios de sangramento de gravidade moderada. Os fatores VIII e IX são essenciais para a coagulação e manutenção da hemostasia. O fator de von Willebrand intercede na agregação plaquetária e também age como carreador para o fator VIII. Fatores de coagulação VII, IX e X são imprescindíveis para a conversão do fator II (protrombina) em trombina; a deficiência de qualquer um deles resulta em sangramento com incapacidade de coagulação sanguínea, que requer tratamento rápido com terapia de reposição.
- A síntese de alguns fatores de coagulação (II, VII, IX, e X) ocorre no fígado e é dependente de vitamina K, cuja deficiência pode provocar hemorragias. Tais fatores de coagulação contêm um aminoácido, o ácido gama carboxiglutâmico (Gla), o qual é produzido por reação de carboxilação de resíduos específicos de ácido glutâmico (Glu). A reação de carboxilação é dependente de vitamina K e capacita os fatores de coagulação citados a se ligarem ao cálcio, permitindo assim a interação com os fosfolipídios das membranas de plaquetas e células endoteliais, o que, por sua vez, possibilita o processo de coagulação sanguínea normal.
Mecanismos reguladores da coagulação sanguínea
As reações bioquímicas da coagulação do sangue devem ser estritamente reguladas, de modo a evitar ativação excessiva do sistema, formação inadequada de fibrina e oclusão vascular. Para tal, a atividade das proteases operantes na ativação da coagulação é regulada por numerosas proteínas inibitórias, que atuam como anticoagulantes naturais, dos quais, os que apresentam maior relevância biológica, atuando como inibidores fisiológicos da coagulação são a antitrombina (AT), o inibidor da via do fator tecidual (TFPI, do inglês, tissue factor pathway inhibitor), a proteína C (PC) e a proteína S (PS).
A antitrombina (AT) (anteriormente designada AT III) é o inibidor primário da trombina e também exerce efeito inibitório sobre diversas outras enzimas da coagulação, incluindo os fatores IXa, Xa e XIa. Adicionalmente, a AT acelera a dissociação do complexo fator VIIa/fator tecidual e impede sua reassociação. Assim, a AT elimina qualquer atividade enzimática procoagulante excessiva ou indesejável. A molécula de heparan sulfato (ou sulfato de heparano), uma proteoglicana presente na membrana das células endoteliais, acelera as reações catalisadas pela AT. A atividade inibitória da AT sobre a coagulação é também potentemente acelerada pela heparina, um polissacarídeo linear, estruturalmente similar ao heparan sulfato.
Conforme mencionado previamente, o complexo fator VIIa/FT atua sobre dois substratos principais: os fatores IX e X da coagulação, ativando-os. Essas reações são reguladas pelo inibidor da via do fator tecidual (TFPI), uma proteína produzida pelas células endoteliais, que apresenta três domínios. O primeiro domínio liga-se ao complexo fator VIIa/FT, inibindo-o, e o segundo domínio liga-se e inibe o fator Xa. Assim, a ativação direta do fator X é regulada negativamente de modo rápido na presença do TFPI, que limita a produção de fator Xa e também do fator IXa. A ligação do fator Xa é necessária para que o TFPI exerça seu papel inibitório sobre o complexo fator VIIa/FT.
Outra importante via de anticoagulação do sangue é o sistema da proteína C ativada (PCa). A PC, quando ligada ao seu receptor no endotélio (EPCR, do inglês endothelial PC receptor), é ativada após a ligação da trombina ao receptor endotelial trombomodulina (TM). A PCa inibe a coagulação, clivando e inativando os fatores Va e VIIIa, processo que é potencializado pela proteína S (PS), que atua como um cofator não enzimático nas reações de inativação.
A identificação do sistema da proteína C ativada (PCa) implicou em importante mudança conceitual no que se refere ao papel da trombina no sistema hemostático: não obstante ela tenha função procoagulante na fisiologia do sistema, onde é produzida apenas em pequenas quantidades, quando gerada em excesso, sua função é a de um potente anticoagulante, tendo em vista que sua ligação à trombomodulina (TM) endotelial representa o evento-chave para ativação da via inibitória da proteína C (PC).
O esquema a seguir apresenta as duas vias de coagulação juntamente com seus mecanismos reguladores (anticoagulantes endógenos intravasculares e seus sítios e ação).
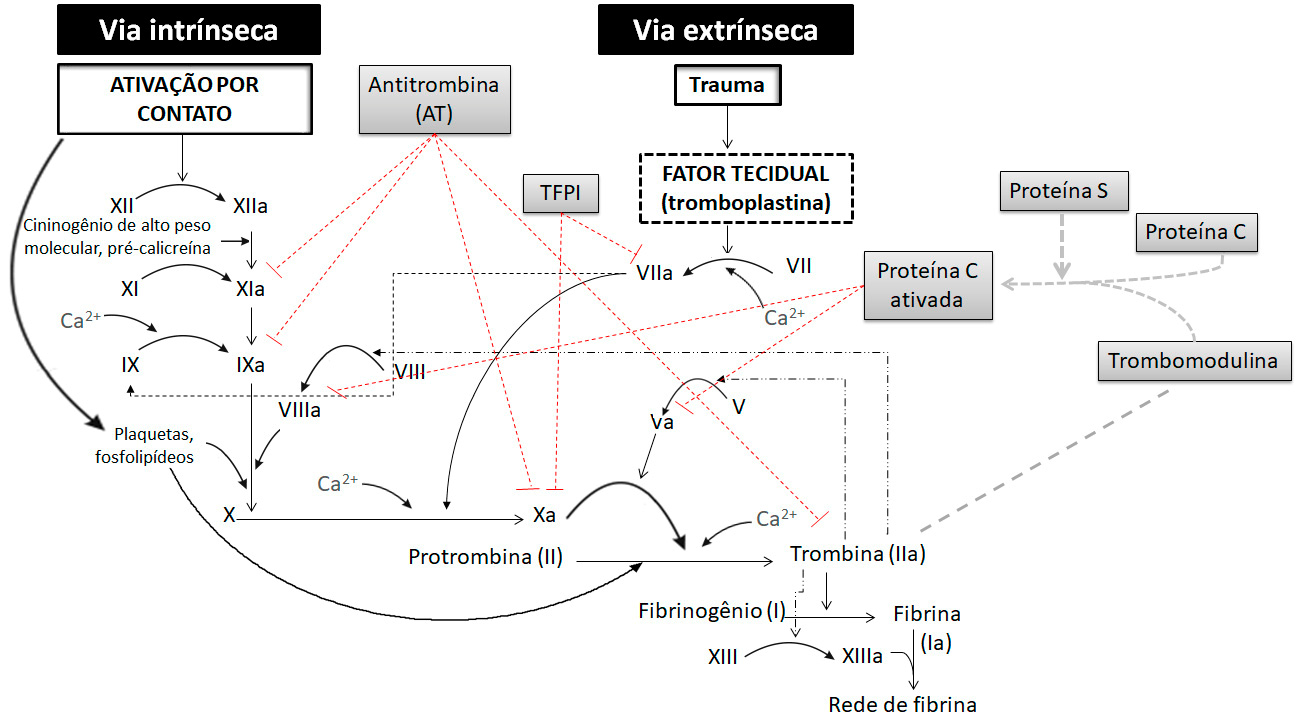
As diferentes vias regulatórias apresentadas não operam isoladamente, pois há sinergismo entre o TFPI e a AT e entre o TFPI e o sistema da PC, suprimindo a gênese de trombina. Em condições fisiológicas (ausência de lesão vascular) há predomínio dos mecanismos anticoagulantes sobre os procoagulantes, mantendo-se, desta forma, a fluidez do sangue e preservando-se a patência vascular (grau de desobstrução vascular). Assim, os distúrbios tromboembólicos são resultantes de um desequilíbrio do sistema hemostático, ocorrendo uma maior propensão à formação de coágulos que, por sua vez, passam a se fixar em determinadas localidades do organismo ou circulam pelo sistema vascular. Os episódios tromboembólicos acometem um grande número de pacientes, especialmente aqueles internados em hospitais, sendo que as complicações decorrentes desses quadros fazem com que parte destes pacientes evolua ao óbito. Entre as complicações, a trombose intracoronariana desempenha um papel fundamental na patogênese do infarto agudo do miocárdio (IAM), sendo que a formação do trombo geralmente precede a lesão do miocárdio.
Sistema de fibrinólise (sistema plasminogênio/plasmina)
A degradação da fibrina em produtos solúveis, denominada fibrinólise, resulta da ação proteolítica de uma enzima ativa, a plasmina, produzida a partir de uma proenzima inativa sintetizada no fígado, o plasminogênio. Assim, a fibrinólise pode ser definida como a degradação do coágulo de fibrina mediada pela plasmina.
O sistema fibrinolítico ou sistema plasminogênio/plasmina é composto por diversas proteínas que regulam a geração de plasmina.
Por ação de ativadores endógenos ocorre alteração na estrutura molecular do plasminogênio que se converte em plasmina, cuja ação é maior no substrato da fibrina. Embora a plasmina degrade não somente a fibrina, mas também o fibrinogênio, o fator V e o fator VIII, em condições fisiológicas, a fibrinólise ocorre como processo que é altamente específico para a fibrina e, portanto de ativação localizada e restrita, cumprindo, assim, sua função de remover o excesso de fibrina do espaço intravascular de modo equilibrado. Esta especificidade dependente de fibrina é resultado de interações moleculares específicas entre os ativadores do plasminogênio, o plasminogênio, a fibrina, e os inibidores da fibrinólise (a2-antiplasmina e PAIs).
São conhecidos dois ativadores fisiológicos do plasminogênio: o ativador do plasminogênio do tipo tecidual (t-PA, do inglês tissue-type plasminogen activator) e o ativador do plasminogênio do tipo uroquinase (u-PA, do inglês urokinase-type plasminogen activator). Esses ativadores do plasminogênio são secretados por macrófagos estimulados por citocinas liberadas pelos linfócitos T. Eles também são liberados por células endoteliais, sendo encontrados em vários leucócitos, eritrócitos, plaquetas e fibroblastos.
A inibição do sistema fibrinolítico pode ocorrer tanto diretamente sobre a plasmina (função inibitória exercida pela 2-antiplasmina) quanto indiretamente, mediante ação de inibidores específicos sobre os ativadores fisiológicos do plasminogênio (inibidores dos ativadores do plasminogênio ou PAIs, do inglês plasminogen activator inhibitors). Os inibidores dos ativadores do plasminogênio podem ser classificados em pelo menos 2 grupos imunologicamente distintos: tipo 1 (PAI-1, principal representante), sintetizado pelo endotélio e pelas plaquetas, e tipo 2 (PAI-2), sintetizado pelos leucócitos e pela placenta.
Mais recentemente foi identificado um novo inibidor do sistema fibrinolítico, designado como TAFI (inibidor da fibrinólise ativado pela trombina, do inglês thrombin-activatable fibrinolysis inhibitor). Curiosamente, a principal via de ativação do TAFI é dependente da ligação do fator IIa (trombina) à trombomodulina (complexo que tem também a função de ativar o sistema da proteína C). Dessa forma, a molécula do TAFI representa um ponto de conexão entre os sistemas de coagulação e fibrinolítico.
O esquema a seguir apresenta a cascata de coagulação, os sítios de ação dos anticoagulantes endógenos intravasculares e a fibrinólise com seus ativadores e inibidores.