Fecundação
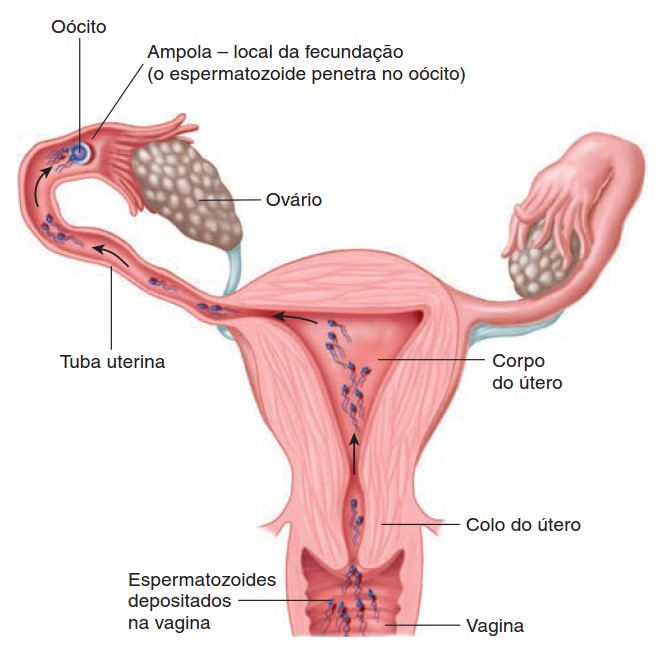
Após os espermatozoides serem ejaculados na vagina durante a relação sexual, eles são transportados pelo colo do útero, pelo corpo do útero e pelas tubas uterinas para as ampolas. Dos aproximadamente 200 milhões de espermatozoides introduzidos na vagina, menos de 2 milhões (1%) alcançam o colo do útero, apenas cerca 200 (0,0001%) chegam até a ampola da tuba uterina, alguns poucos alcançam o ovócito secundário e apenas um único espermatozoide fecunda o ovócito.
Os espermatozoides nadam da vagina para o canal do colo uterino impelidos por movimentos, em forma de chicotada, de suas caudas (flagelos). A passagem dos espermatozoides pelo resto do útero e, em seguida, para as tubas uterinas resulta basicamente das contrações das paredes desses órgãos. Durante a relação sexual, a ocitocina é liberada da neurohipófise da mulher, e o sêmen introduzido na vagina contém prostaglandinas. Ambos estimulam as contrações do músculo liso do útero e das tubas uterinas.
Durante o período no trato genital feminino, mais especificamente nas tubas uterinas, os espermatozoides passam pelo processo de capacitação, uma série de mudanças funcionais que fazem com que a cauda dos espermatozoides bata mais vigorosamente, e preparam sua membrana plasmática para se fundir com a membrana plasmática do ovócito e liberar as enzimas acrossômicas. Durante a capacitação, os espermatozoides sofrem influência das secreções presentes no trato genital feminino, o que resulta na remoção do colesterol, glicoproteínas e proteínas da membrana plasmática em torno da cabeça do espermatozoide.
Normalmente, o local de fecundação é a ampola da tuba uterina, sua porção maior e mais dilatada, e ocorre no período de 12-24 horas após a ovulação, pois o ovócito permanece viável e pode ser fertilizado somente até 24 horas após a ovulação. Lembrando que alguns dos espermatozoides permanecem viáveis no trato genital feminino durante um período médio de até 3 dias (embora a maioria não sobreviva por mais de 48 horas), para que a fecundação seja bem sucedida, o ato sexual deve ocorrer aproximadamente entre quatro dias antes e um dia depois da ovulação.
Se o ovócito secundário não for fecundado aqui, ele passa lentamente em direção ao útero, onde se degenera e é reabsorvido. Embora a fecundação possa ocorrer em outras partes da tuba, ela não ocorre no útero. Sinais químicos (atrativos), secretados pelo ovócito e pelas células foliculares circundantes, guiam os espermatozoides capacitados (quimiotaxia dos espermatozoides) para o ovócito.
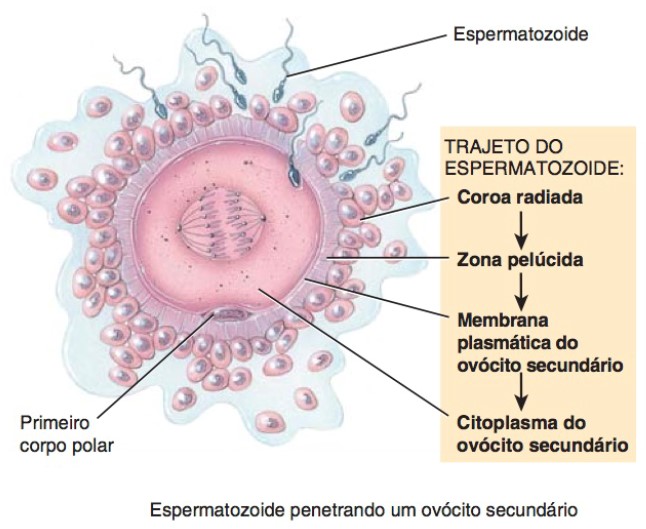
Para que ocorra a fertilização (fecundação), um espermatozoide deve, primeiro, penetrar as duas camadas que circundam o ovócito secundário – a corona radiata e a zona pelúcida –, bem como a membrana plasmática do ovócito.
O acrossomo, uma estrutura semelhante a um capuz que recobre a cabeça de um espermatozoide, contém diversas enzimas. As enzimas acrossômicas e os movimentos vigorosos da cauda, realizados pelo espermatozoide, ajudam-no a penetrar as células da corona radiata e a entrar em contato com a zona pelúcida. Uma das glicoproteínas na zona pelúcida, chamada de ZP3, atua como receptor para os espermatozoides. Sua ligação às proteínas específicas de membrana na cabeça dos espermatozoides provoca a liberação de enzimas acrossômicas, que preparam uma via de passagem pela zona pelúcida, à medida que o chicoteamento da cauda do espermatozoide o impulsiona para a frente.
Embora muitos espermatozoides se liguem à zona pelúcida e liberem suas enzimas, apenas o primeiro espermatozoide a penetrar toda a zona pelúcida e alcançar a membrana plasmática do ovócito se funde com ele. A fusão de um espermatozoide com um ovócito secundário aciona o conjunto de eventos que bloqueia a fertilização por mais de um espermatozoide.
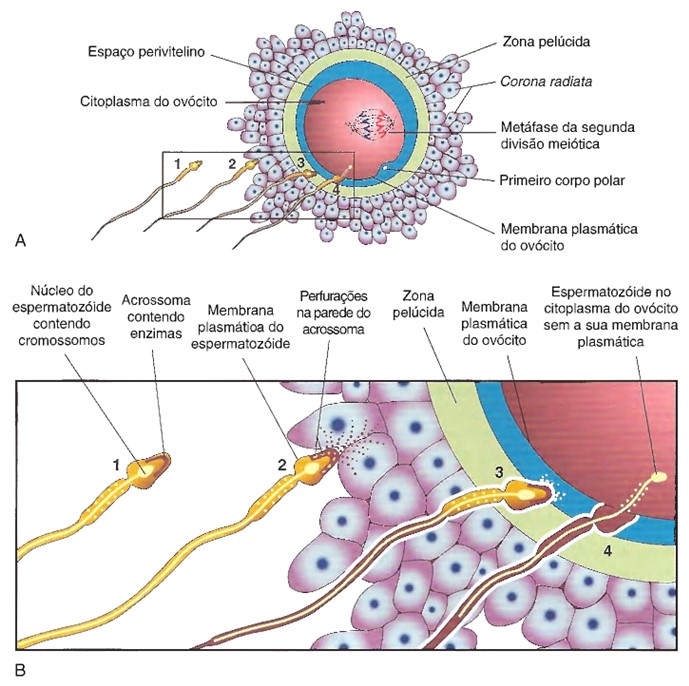
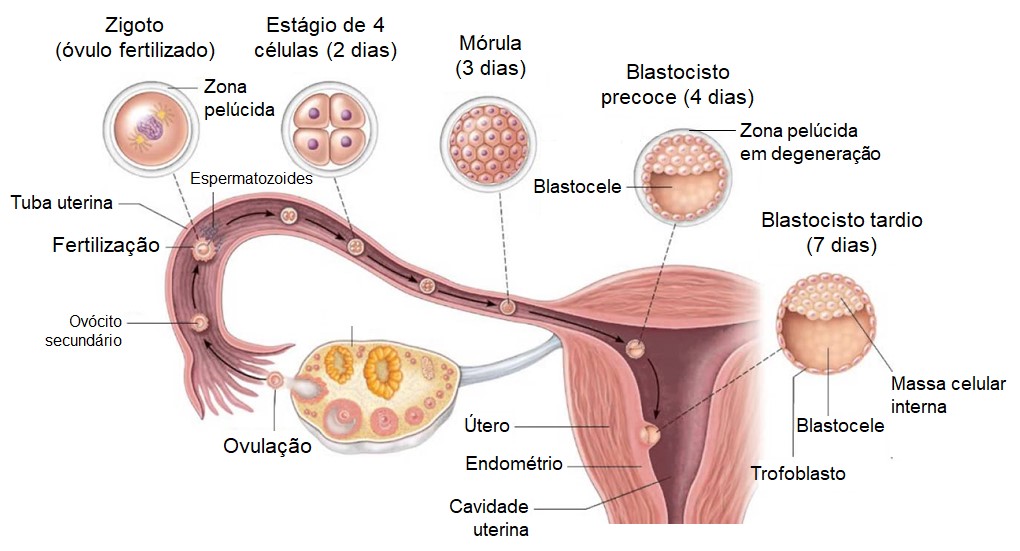
Assim que um espermatozoide entra em um ovócito secundário, o ovócito completa a meiose II, dividindo-se em um óvulo maior e em um segundo corpo polar menor que se fragmenta e se desintegra. Os cromossomos maternos em seguida se descondensam e o núcleo do óvulo torna-se o pronúcleo feminino. Dentro do citoplasma do ovócito, o núcleo do espermatozoide aumenta para formar o pronúcleo masculino e a cauda do espermatozoide degenera. A seguir, ocorre a fusão pronúcleos (células haploides – n), formando o zigoto (óvulo fertilizado) diploide (2n) com 46 cromossomos.
Durante os dias seguintes, ocorre uma sequência de divisões celulares, ao mesmo tempo que o aglomerado das células em desenvolvimento passa das tubas uterinas para o útero. Ao fim de 7 ou 8 dias após a ovulação, o endométrio encontra-se preparado para a implantação do embrião (nidação) no estágio de blastocisto. O estrogênio e a progesterona permitiram-lhe atingir o seu máximo de espessura e de atividade secretora e o blastocisto começa a implantar-se.
No blastocisto, o embrioblasto ou massa celular interna, localizado internamente, depois se transforma no embrião. O trofoblasto, uma camada superficial externa de células que forma a parede do blastocisto, secreta enzimas proteolíticas que digerem as células do endométrio espessado, permitindo-lhe implantar-se profundamente no endométrio; posteriormente, se desenvolve para se tornar a parte fetal da placenta, local de troca de nutrientes e de resíduos entre a mãe e o feto.
Veja também:
- Como acontece a fecundação? A nova visão da Ciência sobre a corrida dos espermatozoides ao óvulo.
- Dá para escolher sexo do bebê pelo dia da relação sexual ou pelo que come?
Gravidez, parto e lactação
Após a implantação, a secreção contínua de progesterona faz com que as células endometriais inchem ainda mais e armazenem mais nutrientes. Essas células são agora chamadas células decíduas e a massa total de células endometriais (endométrio após implantação) é denominada decídua. À medida que as células trofoblásticas invadem a decídua, digerindo-a e envolvendo-a, os nutrientes aí armazenados são usados pelo embrião para crescimento e desenvolvimento. Na primeira semana após a implantação, esse é o único meio pelo qual o embrião consegue obter nutrientes.
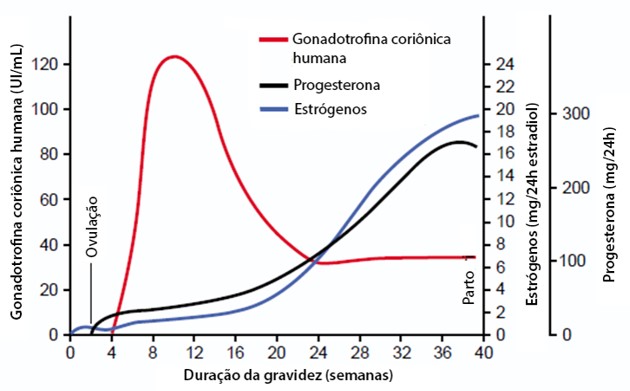
Aproximadamente oito dias após a fertilização, o trofoblasto também secreta um hormônio glicoproteico semelhante ao LH, a gonadotrofina coriônica humana (HCG, do inglês human chorionic gonadotropin), que que evita que o corpo lúteo se degenere até que a placenta esteja pronta para assumir suas tarefas de produção de de progesterona e estrogênios. Esses hormônios mantêm o revestimento do útero em um estado secretor, evitando a menstruação. Testes precoces de gravidez detectam pequenas quantidades de HCG na urina.
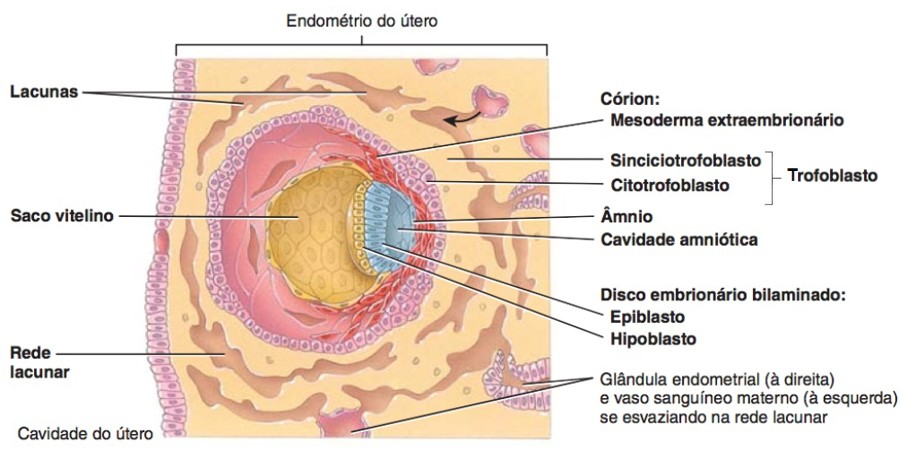
A implantação do blastocisto se completa durante a segunda semana do desenvolvimento. À medida que esse processo prossegue, ocorrem no embrioblasto mudanças morfológicas que produzem um disco embrionário bilaminar que originará duas das três camadas germinativas que formarão todos os tecidos e órgãos do embrião: o endoderma e o ectoderma.
Ao final da segunda semana de desenvolvimento, o embrião encontra-se totalmente envolto pelo tecido uterino. As projeções formadas pela proliferação do trofoblasto na mucosa uterina recebem o nome de vilosidades coriônicas. Os vasos capilares sanguíneos que se desenvolvem nas vilosidades coriônicas auxiliam na troca de nutrientes e gases entre a circulação embrionária e materna. As vilosidades coriônicas ficam envoltas por lacunas sanguíneas, formadas pelo sangue que escapa dos vasos sanguíneos maternos, rompidos pela ação das enzimas das células trofoblásticas. Os elementos nutritivos contidos nesse sangue são aproveitados pelo embrião. Nesse estágio inicial temos a formação de uma placenta primária.
Membranas extraembrionárias
Além das modificações que envolvem a formação do corpo do embrião, surgem, no blastocisto, estruturas anexas que não fazem parte diretamente do disco embrionário, mas que são fundamentais para sua sobrevivência até o nascimento. Essas estruturas são chamadas membranas extraembrionárias (ou anexos embrionários) e correspondem a quatro tipos: âmnio, córion, saco vitelino e alantoide. As membranas extraembrionárias na espécie humana formam-se ainda no estágio de blastocisto, que se completa durante a segunda semana do desenvolvimento.
Resumidamente, as funções dessas membranas extraembrionárias são:
Âmnio: envolve o corpo do embrião delimitando uma cavidade cheia de líquido, a cavidade amniótica ou bolsa amniótica, que protege o embrião e o feto contra choques mecânicos e contra a dessecação. Ajuda também a regular a temperatura corporal.
Córion: membrana extraembrionária mais externa derivada do trofoblasto; envolve o âmnio e no decorrer do desenvolvimento embrionário humano participará da porção fetal da placenta (o córion se torna a principal parte embrionária da placenta). O córion também protege o embrião e o feto das respostas imunológicas da mãe e também produz HCG.
Saco vitelino: a função dessa estrutura, como o próprio nome diz, é armazenar vitelo, substância nutritiva importante para fornecer nutrientes para o embrião durante a segunda e a terceira semanas de desenvolvimento. O saco vitelino também possui diversas outras funções importantes:
- é a fonte de células sanguíneas da terceira à sexta semanas (hematopoese);
- contém as células germinativas primordiais, que posteriormente migrarão para as gônadas em desenvolvimento;
- o teto do saco vitelino forma o revestimento epitelial do tubo digestivo primitivo.
Para maiores informações sobre o saco vitelino, consulte:
- GALDOS-RIVEROS, A.C.; REZENDE, L.C.; PESSOLATO, A.G.T.; MIGLINO, M.A. A relação biológica entre o saco vitelino e o embrião. Enciclopédia Biosfera, Centro Científico Conhecer (Goiânia) 2010; 6(11): 1-13.
Alantoide: última membrana extraembrionária a se diferenciar no desenvolvimento embrionário humano, surge por volta do 16º dia após a fecundação. É um pequeno divertículo não-funcional nos embriões humanos, mas forma os vasos sanguíneos do cordão umbilical e participa da formação da placenta.
Placenta
A placenta é um órgão completo e especializado, com componentes maternos e fetais. No início da 12ª semana, a placenta tem duas partes distintas: (1) a porção fetal, formada pelas vilosidades coriônicas, e (2) a porção materna, formada por parte do endométrio do útero (decídua). Através da placenta a mãe fornece alimento e O2 para o feto, e o feto passa para a circulação materna CO2 e resíduos nitrogenados (ureia, ácido úrico e creatinina) de seu metabolismo. Essas trocas são efetuadas por difusão, graças à proximidade entre vasos sanguíneos maternos e do embrião. Além disso, a placenta também armazena nutrientes, como carboidratos, proteínas, cálcio e ferro liberados na circulação fetal, quando necessário, e produz diversos hormônios que mantêm a gravidez.
É importante ressaltar que não existe continuidade física entre a circulação materna e a embrionária: os vasos sanguíneos da mãe não penetram no corpo do embrião, mas formam lacunas sanguíneas ao redor do tecido fetal da placenta, que é ricamente vascularizado. Os vasos sanguíneos do embrião também não penetram no corpo da mãe. Assim, o sangue da mãe nunca se mistura ao sangue fetal porque os vasos sanguíneos de ambos não se encontram. É uma barreira natural, chamada barreira hemato-placentária (ou simplesmente barreira placentária), que impede a passagem de algumas substâncias e de alguns agentes infecciosos, como por exemplo, bactérias, protozoários e vermes. Porém, determinados vírus como os que causam Aids, rubéola, catapora, sarampo, encefalite e poliomielite, conseguem atravessar a placenta, bem como muitos medicamentos, álcool e outras substâncias que podem provocar defeitos congênitos.
Para maiores informações sobre a barreira placentária, consulte:
- BROLIO, M.P.; AMBRÓSIO, C.E.; FRANCIOLLI, A.R.; MORINI, A.C.; GUERRA, R.R.; MIGLINO, M.A. A barreira placentária e sua função de transferência nutricional. Rev Bras Reprod Anim 2010; 34(4): p.222-232.
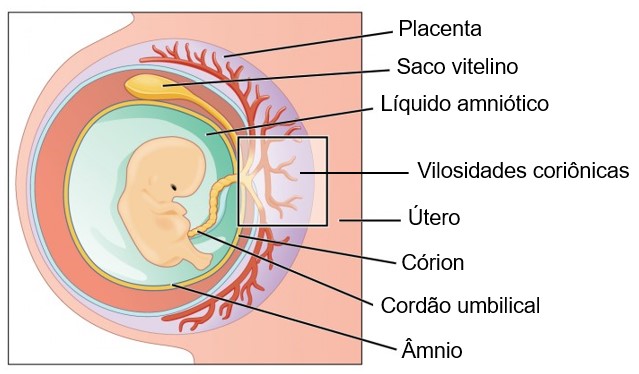
A verdadeira conexão entre a placenta e o embrião e, mais tarde, o feto é o cordão umbilical, que se desenvolve a partir do pedículo de conexão, uma outra estrutura extraembrionária que aparece durante a segunda semana, juntamente com a cavidade amniótica, o âmnio, o saco vitelino e o córion. O cordão umbilical consiste em duas artérias umbilicais, que transportam o sangue fetal desoxigenado (sangue venoso) para a placenta; uma veia umbilical, que transporta o sangue materno oxigenado (sangue arterial) para o feto; e tecido conjuntivo de sustentação. Uma camada de âmnio circunda todo o cordão umbilical e lhe dá uma aparência brilhante.
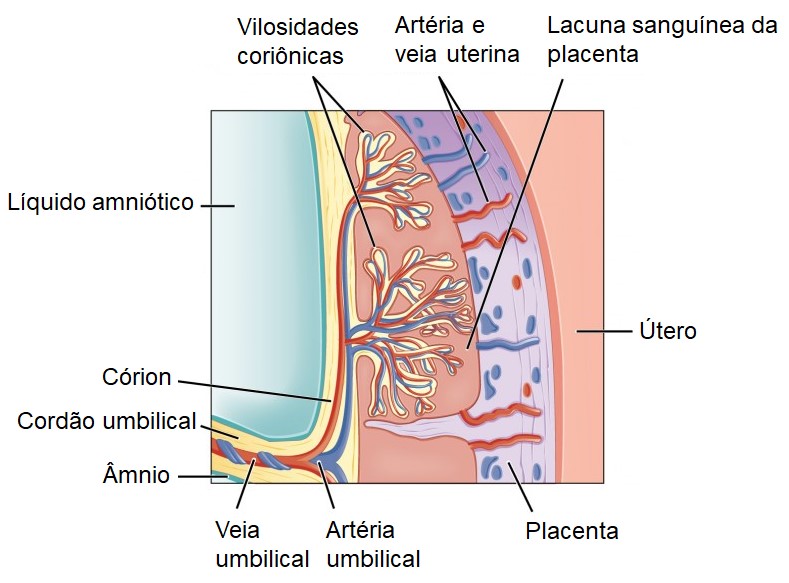
No fim da terceira semana, os vasos capilares sanguíneos que se desenvolvem nas vilosidades coriônicas se conectam ao coração embrionário por meio das artérias umbilicais e da veia umbilical.
Após o nascimento do bebê, a placenta se descola do útero e o cordão umbilical é clampeado (pinçado ou amarrado) e cortado. A pequena porção (aproximadamente 2,54 cm) do cordão que permanece ligada à criança começa a secar e cai, geralmente, entre 12 e 15 dias após o nascimento. A área em que o cordão estava fixado se torna recoberta por uma fina camada de pele, e começa a formação do tecido cicatricial. A cicatriz é o umbigo.
Desenvolvimento embrionário subsequente
A terceira semana do desenvolvimento embrionário ocorre durante a semana que se segue à ausência do primeiro período menstrual (cerca de 3 semanas após a concepção), isto é, 5 semanas depois do primeiro dia do último período menstrual normal, primeira indicação de que uma mulher pode estar grávida.
O principal evento da terceira semana de desenvolvimento é chamado de gastrulação. Nesse processo, o disco embrionário bilaminado se transforma em um disco embrionário trilaminado, composto por três camadas germinativas primárias – ectoderma, mesoderma e endoderma –, principais tecidos embrionários, a partir dos quais todos os vários tecidos e órgãos do corpo se desenvolverão.
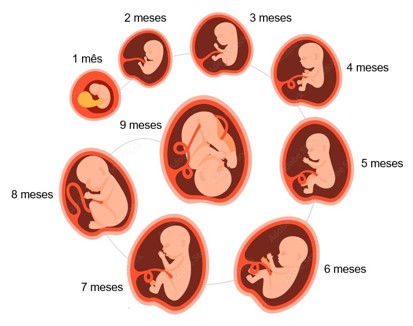
A partir da quarta semana de gestação tem início a organogênese, fase que termina por volta da oitava semana de gestação. Dizemos, então, que o período embrionário vai da fecundação até a oitava semana de gestação; nessa etapa, utiliza-se o termo embrião. A partir daí, o indivíduo em formação passa a ser chamado feto. O período fetal vai da nona semana até o nascimento.
O período entre a quanta e a oitava semanas é muito significativo para o desenvolvimento embrionário, porque todos os principais órgãos aparecem durante esse período. No final da oitava semana, todos os principais sistemas do corpo já começaram a se desenvolver, ainda que suas funções, geralmente, sejam mínimas.
Durante o período fetal, tecidos e órgãos que se desenvolveram no período embrionário crescem e se diferenciam. A partir da 9ª semana até o nascimento, que ocorre em geral por volta da 39-40ª semana de gestação, verifica-se rápido crescimento do corpo do feto, que tem praticamente todos os seus tecidos, órgãos e sistemas já formados.
Veja também:
- A gravidez por dentro - 1 a 9 semanas - BabyCenter
- A gravidez por dentro - 10 a 14 semanas - BabyCenter
- A gravidez por dentro - 15 a 20 semanas - BabyCenter
- A gravidez por dentro - 21 a 27 semanas - BabyCenter
- A gravidez por dentro - 28 a 37 semanas - BabyCenter
Alterações fisiológicas maternas na gravidez
A gestação produz profundas alterações no organismo materno com o objetivo fundamental de adequá-lo às necessidades orgânicas próprias do complexo materno-fetal e do parto. Inicialmente estas alterações se devem às ações hormonais provenientes do corpo lúteo e da placenta e a partir do segundo trimestre, também ao crescimento uterino. As principais modificações da fisiologia materna ocorrem no sistema cardiocirculatório, respiratório e gastrintestinal, além das metabólicas e hematológicas.
Abordaremos aqui as ações hormonais que conduzem às modificações fisiológicas citadas.
Para maiores informações e detalhes sobre as modificações fisiológicas da gravidez, consulte:
- ALVES, T.V.; BEZERRA, M.M.M. Principais alterações fisiológicas e psicológicas durante o Período Gestacional. Id on Line Rev Mult Psic 2020; 14(49): 114-126.
- BURTI, J.S.; DE ANDRADE, L.Z.; CAROMANO, F.A.; IDE, M.R. Adaptações fisiológicas do período gestacional. Fisioterapia Brasil 2006; 7(5): 375-380.
- PICON, J.D.; DE SÁ, A.M.P.O.A. Alterações hemodinâmicas da gravidez. Revista da Sociedade de Cardiologia do Rio Grande do Sul - Ano XIV nº 05 Mai/Jun/Jul/Ago 2005.
- REIS, G.F.F. Alterações Fisiológicas Maternas da Gravidez. Rev Bras Anest 1993; 43: 1: 3- 9.
Hormônios da gravidez
Hormônios placentários
Na gravidez, a placenta forma quantidades especialmente grandes de gonadotropina coriônica humana (HCG), progesterona, estrogênios e somatomamotropina coriônica humana (HCS), também conhecida como hormônio lactogênico placentário humano (HPL), sendo que os três primeiros, e provavelmente também HPL, são essenciais a uma gestação normal. A relaxina e o hormônio liberador de corticotropina (CRH) são outros dois hormônios produzidos pela placenta.
HCG
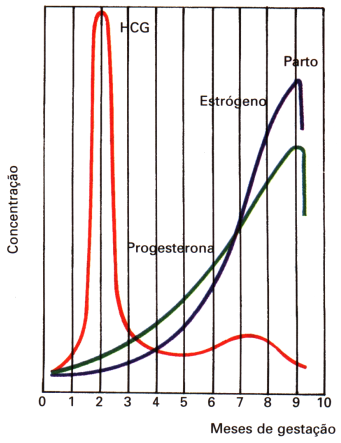
A principal função fisiológica do HCG é a de manter o corpo lúteo, de modo que as taxas de progesterona e estrogênios não diminuam, garantindo, assim, a manutenção da gravidez (inibição da menstruação) e a ausência de nova ovulação.
Por volta da 15ª semana de gestação, com a placenta já formada e madura produzindo estrógeno e progesterona, ocorre declínio acentuado na concentração de HCG e involução do corpo lúteo (o corpo lúteo involui naturalmente depois de 13-17 semanas de gestação).
O HCG também concede uma imunossupressão à mulher, para que ela não rejeite o embrião. Tem ainda atividade tireotrófica semelhante ao TSH (hormônio estimulante da tireoide), estimulando a liberação dos hormônios tireoidianos nas primeiras 8 a 14 semanas da gravidez. Isto gera feedback negativo no eixo hipotalâmico-hipofisário, com redução do TSH nessa fase gestacional. A função tireoidiana começa a retornar ao normal com aproximadamente 20 semanas de gestação.
O HCG igualmente exerce efeito estimulante sobre as células intersticiais dos testículos, com consequente produção de testosterona pelo feto masculino. Essa pequena secreção de testosterona durante a gestação é o fator responsável pelo crescimento dos órgãos sexuais masculinos do feto (diferenciação sexual do feto do sexo masculino).
Para maiores detalhes, consulte:
- BÁRTHOLO, B.B.G.R.; MONTEIRO, D. L.M.; TRAJANO, A.J.B. Hipertireoidismo na gestação. Revista HUPE 2014; 13(3):73-80.
- BARTOCCI, A. WELKER, R.D.; SCHLICK, E.; CHIRIGOS, M.A.; NISULA, B.C. Immunosuppressive activity of human chorionic gonadotrophin preparations in vivo: evidence for gonadal dependence. Cell Immunol 1983; 82(2): 334-342.
- FETTKE, F.; SCHUMACHER, A.; CANELLADA, A.; TOLEDO, N.; BEKEREDJIAN-DING, I.; BONDT, A.; WUHRER, M.; COSTA, S.-D.; ZENCLUSSEN, A.C. Maternal and fetal mechanisms of B cell regulation during pregnancy: human chorionic gonadotropina stimulates B cells to produce IL-10 while alphafetoprotein drives them into apoptosis. Front Immunol 2016; 7: 495.
- HENNEN, G.; PIERCE, J.G.; FREYCHET, P. Human Chorionic Thyrotropin: Further Characterization and Study of Its Secretion During Pregnancy. J Clin Endocrinol Metab 1969; 29(4): 581-594.
- HOSSEINI, S.; MEHRZAD, S.; HASSANZADEH, H.; BIDKHORI, H.R.; MIRAHMADI, M.; MOMENI-MOGHADDAM, M.; SADEGHIFAR, F.; FARSHCHIAN, M. Immunosuppressive Effects of Human Chorionic Gonadotropin (hCG) on Mesenchymal Stromal Cells. J Cell Mol Res (JCMR) 2020; 11: 90-98.
- SCHUMACHER, A.; BRACHWITZ, N.; SOHR, S.; ENGELAND, K.; LANGWISCH, S.; DOLAPTCHIEVA, M.; ALEXANDER, T.; TARAN, A.; MALFERTHEINER, S.F.; COSTA, S.-D. Human chorionic gonadotropin attracts regulatory T cells into the fetal-maternal interface during early human pregnancy. J Immunol 2009; 182: 5488-5497.
- YOSHIMURA, M.; HERSHMAN, J.M. Thyrotropic action of human chorionic gonadotropin. Thyroid 1995; 5(5): 425-434.
Progesterona
A progesterona aumenta o endométrio, pois se o endométrio não estiver bem desenvolvido, poderá ocorrer um aborto natural. Também relaxa a musculatura lisa, o que diminui a contração uterina para não ter a expulsão do feto. Este hormônio é importante para o equilíbrio hidroeletrolítico, além de estimular o centro respiratório no cérebro, fazendo com que aumente a ventilação, e consequentemente, fazendo com que a mãe mande mais oxigênio para o feto. Complementa os efeitos do estrogênio nas mamas, promovendo o crescimento dos elementos glandulares, o desenvolvimento do epitélio secretor e a deposição de nutrientes nas células glandulares, de modo que, quando a produção de leite for solicitada, a matéria-prima já está presente.
Estrogênios
Os estrogênios promovem (1) rápida proliferação da musculatura uterina; (2) grande desenvolvimento do sistema vascular do útero; (3) aumento dos órgãos sexuais externos e da abertura vaginal, proporcionando uma via mais ampla para o parto; (4) rápido aumento das mamas; e (5) contribui ainda para a manutenção hídrica e aumenta a circulação. Divididos em estradiol e estrona, presentes na corrente materna, e estriol, presente na corrente fetal, é medido para avaliar a função feto-placentária e o bem estar fetal.
Hormônio lactogênico placentário humano (HPL)
A somatomamotropina coriônica humana (HCS) ou hormônio lactogênico placentário humano (HPL) é um hormônio proteico, de estrutura química semelhante à da prolactina e da somatotropina hipofisária (hormônio do crescimento – GH). É encontrado no plasma da gestante a partir da 4ª semana de gestação. Tem efeito lipolítico, aumenta a resistência materna à ação da insulina e estimula o pâncreas na secreção de insulina, ajudando no crescimento fetal, pois proporciona maior quantidade de glicose e de nutrientes para o feto em desenvolvimento.
Relaxina
A relaxina, um hormônio produzido primeiramente pelo corpo lúteo do ovário e mais tarde pela placenta, aumenta a flexibilidade da sínfise púbica e dos ligamentos das articulações sacroilíaca e sacrococcígea, ajudando a dilatar o colo do útero durante o trabalho de parto. Ambas as ações facilitam o parto do bebê.
Hormônio liberador de corticotropina (CRH)
O hormônio mais recentemente encontrado, produzido pela placenta, é o hormônio liberador de corticotropina (CRH) que, em mulheres não grávidas, é secretado apenas pelas células neurossecretoras situadas no hipotálamo. O CRH é considerado, atualmente, como sendo parte do "relógio" que estabelece as condições do nascimento. A secreção do CRH pela placenta começa por volta da 12ª semana e aumenta muito até o final da gravidez. Mulheres que têm níveis mais altos de CRH no início da gravidez mais provavelmente darão à luz prematuramente; aquelas cujos níveis são baixos mais provavelmente darão à luz depois do previsto. O CRH proveniente da placenta tem um segundo efeito importante: aumenta a secreção de cortisol, que é necessário para o amadurecimento dos pulmões fetais e para a produção de surfactante.
OBS.:
O surfactante é uma mistura contendo proteínas e fosfolipídeos que são secretados dentro do espaço aéreo dos alvéolos pulmonares por células epiteliais especiais secretoras chamadas de células epiteliais alveolares tipo II, que constituem cerca de 10% da área de superfície alveolar. A função do surfactante é a de reduzir a tensão superficial do fluido alveolar (camada de água dentro dos alvéolos), evitando o colabamento alveolar e poupando energia corporal por exigir menor esforço dos músculos inspiratórios durante a expansão pulmonar.
Para que um recém-nascido seja capaz de respirar independentemente, os alvéolos pulmonares devem ser capazes de permanecerem abertos e cheios de ar após o nascimento. Eles conseguem fazê-lo em grande parte graças ao surfactante produzido por células dos próprios alvéolos pulmonares à medida que os pulmões do feto amadurecem (frequentemente em torno da 34ª semana e quase sempre em torno da 37ª semana de gestação).
Outros fatores hormonais na gravidez
Quase todas as glândulas endócrinas não-sexuais maternas reagem também de maneira marcante à gravidez, o que resulta basicamente do aumento da carga metabólica da mãe, mas também, até certo ponto, dos efeitos dos hormônios placentários sobre a hipófise e outras glândulas. Alguns dos efeitos mais notáveis são apresentados.
Para maiores informações, consulte:
- BURTI, J.S.; DE ANDRADE, L.Z.; CAROMANO, F.A.; IDE, M.R. Adaptações fisiológicas do período gestacional. Fisioterapia Brasil 2006; 7(5): 375-380.
Secreção hipofisária
A adenohipófise materna aumenta pelo menos 50% durante a gravidez, aumentando sua produção de corticotropina (ACTH), tireotropina (TSH) e prolactina (PRL). Por outro lado, a secreção hipofisária do hormônio folículo-estimulante (FSH) e do hormônio luteinizante (LH) é quase totalmente suprimida em consequência dos efeitos inibidores da progesterona e dos estrogênios da placenta.
Alterações pigmentares são extremamente comuns, acometendo até 90% das gestantes. A hiperpigmentação costuma ser generalizada, com acentuação das regiões normalmente mais pigmentadas, como aréolas mamárias, genitália, períneo, axilas e face interna das coxas. O quadro tende a regredir no pós-parto, mas a pele geralmente não retorna à coloração inicial. Fatores responsáveis pela etiologia da hiperpigmentação dessas áreas incluem maior população de melanócitos e maior susceptibilidade ao estímulo hormonal como, por exemplo, elevação dos níveis de hormônio estimulante dos melanócitos (MSH), secretado pela hipófise intermediária.
Para maiores detalhes, consulte:
- ALVES, G.F.; NOGUEIRA, L.S.C.; VARELLA, T.C.N. Dermatologia e gestação. An Bras Dermatol 2005; 80(2): 179-186.
Secreção de corticosteroides (adrenais)
A taxa de secreção adrenocortical de glicocorticoides (cortisol) está moderadamente elevada durante a gravidez. É possível que esses glicocorticoides ajudem a mobilizar aminoácidos dos tecidos maternos de maneira que possam ser usados na síntese de tecidos no feto.
A gestante geralmente sofre também um aumento de cerca de duas vezes na secreção de aldosterona, atingindo um pico no final da gravidez. Isto, em conjunto com as ações dos estrogênios, causa uma tendência, mesmo na gestante normal, de reabsorver sódio nos túbulos renais e, portanto, de reter líquido, levando ocasionalmente à hipertensão induzida pela gravidez.
OBS.:
Existe semelhança química entre os estrogênios e os hormônios adrenocorticais. Os estrogênios, assim como a aldosterona e alguns outros hormônios adrenocorticais, causam retenção de sódio e água nos túbulos renais. Esse efeito dos estrogênios é normalmente brando e raramente tem significância, mas durante a gravidez, a enorme formação de estrogênios pela placenta pode contribuir para a retenção de líquidos no corpo.
Secreção da tireoide
A glândula tireoide materna aumenta em geral até 50% durante a gravidez, aumentando também sua produção dos hormônios metabólicos T3 (triiodotironina) e T4 (tetraiodotironina ou tiroxina) em uma quantidade correspondente, principalmente de T4. Observa-se, assim, aumento no metabolismo basal da mãe e do feto (juntos aumentam em até 25%), que recorre em gasto médio de 300 quilocalorias por dia. Isso ocorre a partir do terceiro mês até o último trimestre.
Para maiores detalhes, consulte:
- MACIEL, L.M.Z.; MAGALHÃES, P.K.R. Tireoide e Gravidez. Arq Bras Endocrinol Metab 2008; 52(7): 1084-1095.
Secreção das paratireoides
Durante a gestação, as glândulas paratireoides maternas geralmente aumentam, tornando-se hiperplásicas e hiperfuncionantes, aumentando, assim, a concentração plasmática do paratormônio (PTH), especialmente verdadeiro se a mãe estiver sob uma dieta deficiente em cálcio.
O aumento dessas glândulas causa absorção de cálcio dos ossos maternos, mantendo uma concentração normal de íons cálcio no líquido extracelular materno mesmo quando o feto remove cálcio para ossificar seus próprios ossos. Essa secreção de hormônio paratireoide é ainda mais intensificada durante a lactação após o nascimento do bebê, porque o bebê em crescimento requer mais cálcio do que o feto.
Se houver insuficiência das paratireoides, pode ocorrer excitabilidade muscular aumentada e assim, a gestante pode desenvolver câimbras (ou cãibras). Se a mãe tem hipoparatireoidismo pode haver hiperplasia das paratireoides do feto e vice-versa. Portanto, se um recém-nascido apresentar um distúrbio esquelético, não se pode descartar a hipótese da mãe ter um distúrbio nas paratireoides, no caso uma hiperfunção, que causaria hipofunção no feto, que não teria fornecimento adequado de cálcio para formação do esqueleto.
Mudanças hormonais e mecânicas no parto
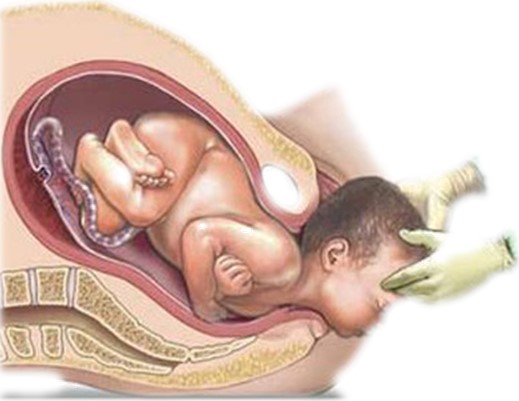
Ao final da gravidez, o útero torna-se progressivamente mais excitável, até que finalmente desenvolve contrações rítmicas tão fortes que o bebê é expelido. Não se sabe a causa exata do aumento da atividade uterina, mas pelo menos duas categorias principais de eventos levam às contrações intensas responsáveis pelo parto:
- mudanças hormonais progressivas que aumentam a excitabilidade da musculatura uterina (o início do trabalho de parto é determinado por interações complexas dos diversos hormônios placentários e fetais);
- mudanças mecânicas progressivas.
Fatores hormonais que aumentam a contratilidade uterina
CRH placentário e eixo adrenal fetal. A produção placentária do hormônio liberador de corticotropina (CRH placentário) e os níveis séricos maternos de CRH aumentam rapidamente durante o final da gestação e o trabalho de parto. O CRH placentário se acumula na circulação fetal e estimula a secreção de ACTH (hormônio adrenocorticotrópico) pelo feto. O ACTH, então, estimula a glândula suprarrenal do feto a secretar tanto cortisol quanto desidroepiandrosterona (DHEA), o principal androgênio suprarrenal. A placenta, então, converte o DHEA em estrogênio. O cortisol, por sua vez, estimula ainda mais a produção placentária de CRH (em contraste com o efeito inibitório do cortisol sobre a produção hipotalâmica de CRH). Isso estabelece um feedback positivo autoamplificador. O CRH por si só promove contrações do miométrio, sensibilizando o útero à ocitocina e às prostaglandinas. Os estrogênios também estimulam a contratilidade do miométrio direta e indiretamente. Além disso, esse modelo correlaciona o início do trabalho de parto à maturação induzida pelo cortisol dos sistemas fetais, incluindo os pulmões e o trato gastrintestinal.
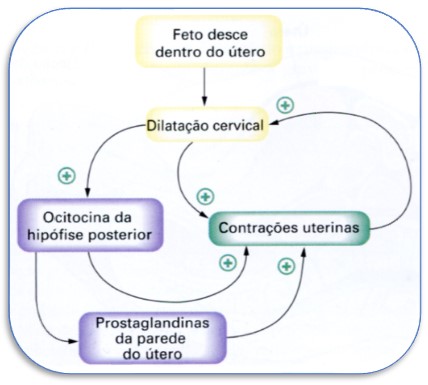
Efeitos dos hormônios fetais sobre o útero. A neurohipófise do feto também secreta grandes quantidades de ocitocina, o que teria um papel na excitação uterina. Além disso, as membranas fetais liberam prostaglandinas em concentrações elevadas no momento do trabalho de parto, as quais também podem aumentar a intensidade das contrações uterinas.
Maior proporção de estrogênios em relação à progesterona. A progesterona inibe a contratilidade uterina durante a gravidez, ajudando, assim, a evitar a expulsão do feto. Por outro lado, os estrogênios têm uma tendência definida em aumentar o grau de contratilidade uterina. Tanto a progesterona quanto os estrogênios são secretados em quantidades progressivamente maiores durante grande parte da gravidez, mas a partir do sétimo mês a de estrogênio continua a aumentar, enquanto a de progesterona permanece constante ou até mesmo diminui um pouco. Próximo do final da gestação, os níveis de estrogênios no sangue materno aumentam acentuadamente, produzindo mudanças que superam os efeitos de inibição da progesterona. Níveis altos de estrogênios fazem com que a quantidade de receptores para ocitocina nas fibras musculares do útero aumentem. Os estrogênios também estimulam a placenta a liberar prostaglandinas, que induzem a produção de enzimas que digerem fibras colágenas no colo do útero, amolecendo-o.
Efeito da relaxina no útero. A relaxina proveniente da placenta, aumenta a flexibilidade da sínfise púbica, ajudando a dilatar o colo do útero.
Efeito da ocitocina no útero. A ocitocina, hormônio produzido pelo hipotálamo e secretado pela neurohipófise, estimula fortes contrações uterinas, desempenhando um papel importante na progressão e na conclusão do parto. A ocitocina é liberada em resposta à dilatação do colo do útero, através de um reflexo neuroendócrino.
Fatores mecânicos que aumentam a contratilidade uterina
Distensão da musculatura uterina. A simples distensão de órgãos de musculatura lisa geralmente aumenta a sua contratilidade. Ademais, a distensão intermitente, como ocorre repetidamente no útero por causa dos movimentos fetais, pode também provocar a contração dos músculos lisos. As contrações do útero ocorrem em ondas (muito semelhantes às ondas peristálticas do trato gastrointestinal), que começam no topo do útero e se movem para baixo, finalmente, expelindo o feto.
Distensão ou dilatação do colo uterino. Há razões para acreditarmos que a dilatação cervical (do colo do útero) seja particularmente importante em provocar contrações uterinas. por exemplo, o obstetra muitas vezes induz o trabalho de parto rompendo as membranas de maneira que a cabeça do bebê distenda o colo uterino mais efetivamente do que o usual ou irritando-o de outras formas.
Trabalho de parto
O trabalho de parto verdadeiro começa quando as contrações do útero ocorrem a intervalos regulares, normalmente produzindo dor. À medida que o intervalo entre as contrações diminui, as contrações se intensificam. Outro sintoma do trabalho de parto verdadeiro, em algumas mulheres, é a localização da dor no dorso, que é intensificada pelo caminhar. O indicador mais confiável do trabalho de parto verdadeiro é a dilatação do colo do útero e a perda do tampão mucoso, uma descarga de muco, contendo sangue, no canal do colo do útero.
No trabalho de parto falso (contrações de Braxton Hicks) a dor é sentida no abdome, a intervalos irregulares, mas não se intensifica e não é alterada significativamente pelo caminhar. Não há perda do tampão mucoso e nenhuma dilatação do colo do útero.
O trabalho de parto verdadeiro pode ser dividido em três estágios:
1- Estágio de dilatação. O período do início do trabalho de parto até a dilatação completa do colo do útero é o estágio de dilatação. Este estágio, que normalmente dura 6-12 horas, caracteriza-se por contrações regulares do útero, em geral, com o rompimento da bolsa amniótica e dilatação completa (até 10 cm) do colo do útero. Se a bolsa amniótica não se rompe espontaneamente, é rompida intencionalmente.
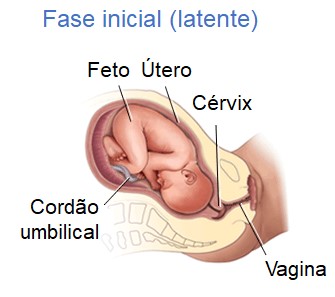
A primeira fase do estágio de dilatação é chamada de fase latente, quando as contrações estão se tornando mais frequentes (geralmente com intervalos de 5 a 20 minutos) e um pouco mais fortes. No entanto, o desconforto é mínimo. O colo do útero se dilata (abre aproximadamente 3 ou 4 cm) e fica mais fino. Algumas mulheres podem não reconhecer que estão em trabalho de parto se as contrações forem leves e irregulares.
A fase latente é geralmente a fase mais longa e menos intensa do trabalho de parto. A futura mamãe geralmente é internada no hospital durante essa fase. Os exames pélvicos são realizados para determinar a dilatação do colo do útero.
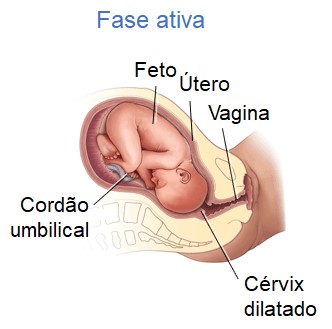
A segunda fase do estágio de dilatação é a fase ativa, sinalizada pela dilatação do colo uterino de 4 a 7 centímetros. As contrações se tornam mais longas, mais graves e mais frequentes (geralmente com intervalo de 3 a 4 minutos).

A terceira fase é chamada de transição e é a última fase do estágio de dilatação. Durante a transição, o colo do útero dilata de 8 a 10 centímetros. As contrações costumam ser muito fortes, durando de 60 a 90 segundos e ocorrendo a cada poucos minutos. A maioria das mulheres sente vontade de fazer força durante esta fase.
Na maioria dos casos, as fases ativa e de transição são mais curtas do que a fase latente.
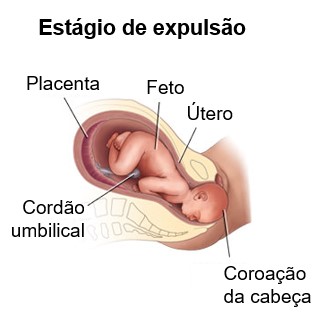
2- Estágio de expulsão. O período (10 minutos a diversas horas) a partir da dilatação completa do colo do útero até o parto do bebê é o estágio de expulsão.
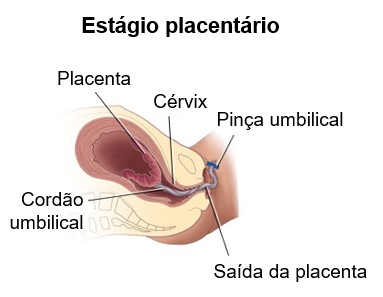
3- Estágio placentário. O período (5-30 minutos ou mais) após o parto até a expulsão da placenta, ou das "secundinas", pelas poderosas contrações do útero é o estágio placentário. Essas contrações também comprimem os vasos sanguíneos que foram rompidos durante o parto, reduzindo, assim, a probabilidade de hemorragia.
Como regra, o trabalho de parto dura mais no primeiro parto, em geral, aproximadamente 14 horas. Para mulheres que já engravidaram, a duração média do trabalho de parto é de aproximadamente 8 horas, embora o tempo varie muito entre os nascimentos.
Como o feto pode ser espremido pelo canal do parto (colo do útero e vagina) desde alguns minutos até diversas horas, algum grau de hipóxia intermitente acaba ocorrendo, em razão da compressão do cordão umbilical e da placenta durante as contrações uterinas. A hipóxia fetal provoca uma reação enérgica de alarme, provocando liberação dos hormônios do estresse adrenalina (epinefrina) e noradrenalina (norepinefrina), provenientes das glândulas suprarrenais (adrenais) e do sistema nervoso simpático. O fluxo sanguíneo para os tecidos periféricos é reduzido, sendo o sangue redirecionado para os órgãos centrais (coração e cérebro) e para as adrenais. O feto pode suportar este grau de hipóxia durante diversas horas sem quaisquer danos, desde que os órgãos centrais prioritários assegurem seu fornecimento de sangue, glicose e oxigênio. Grande parte da proteção contra o estresse do parto, bem como da preparação do recém-nascido para sobreviver à vida extrauterina é fornecida por esses hormônios.
Veja também:
- A gravidez por dentro - o parto normal - BabyCenter
Os hormônios e os mecanismos da lactação
Lactação é a secreção e a ejeção (liberação) de leite a partir das glândulas mamárias. O hormônio principal na promoção da síntese e secreção de leite é a prolactina (PRL), secretada pela adenohipófise materna. A ocitocina provoca a liberação de leite nos ductos mamários via reflexo de ejeção do leite. O leite, formado pelas células glandulares das mamas, é armazenado até que o bebê comece a sucção ativa. Em mães que amamentam, a sucção estimula as terminações nervosas nos mamilos, desencadeando a secreção de ocitocina e prolactina.
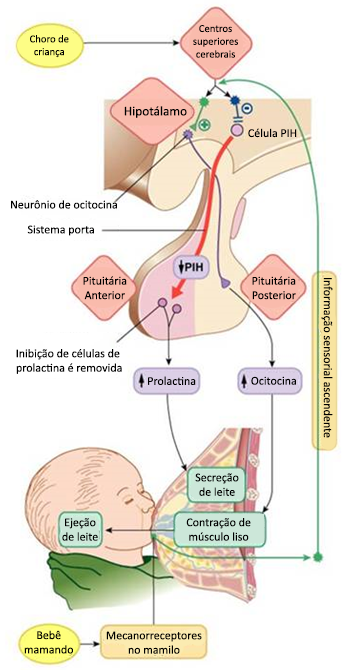
O ato de mamar promove a inibição da secreção de PIH (hormônio inibidor da prolactina) pelo hipotálamo, causando assim a secreção da prolactina, que estimula a produção e a secreção de leite para os alvéolos mamários. Porém, o leite não flui com facilidade dos alvéolos para o sistema de dutos e, portanto, não drena de modo contínuo pelos mamilos. Assim, o leite deve ser ejetado ou "descer" dos alvéolos para os dutos para que o bebê possa obtê-lo. Esse processo é desencadeado por um reflexo combinado neurogênico e hormonal, envolvendo o hormônio neurohipofisário ocitocina. Quando o bebê suga, ocorre transmissão de impulsos sensitivos por nervos somáticos dos mamilos até a medula espinhal e, daí, para o hipotálamo, ocasionando também a secreção de ocitocina. A ocitocina é, então, transportada pelo sangue até as mamas, onde provoca a contração das células mioepiteliais que circundam as paredes externas dos alvéolos, expelindo, assim, o leite dos alvéolos para os dutos e sua ejeção (veja também Funções da prolactina e da ocitocina na amamentação).
O líquido secretado durante os últimos dias antes e nos primeiros dias após o parto é denominado colostro, que contém essencialmente as mesmas concentrações de proteínas e lactose do leite, mas quase nenhuma gordura, e sua taxa máxima de produção é cerca de 1/100 da taxa subsequente de produção de leite.
Imediatamente depois que o bebê nasce, a perda súbita tanto da secreção de estrogênio quanto da progesterona da placenta permite que o efeito lactogênico da prolactina assuma seu papel natural de promotor da lactação, e, durante os próximos 1 a 7 dias, as mamas começam a secretar quantidades abundantes de leite em vez de colostro. Esta secreção de leite requer uma secreção de suporte adequada da maioria dos outros hormônios maternos também, porém os mais importantes são o hormônio do crescimento (GH), cortisol, paratormônio e insulina. Esses hormônios são necessários para fornecer aminoácidos, ácidos graxos, glicose e cálcio fundamentais para a formação do leite.
OBS.:
Embora os estrogênios e a progesterona sejam essenciais ao desenvolvimento físico das mamas durante a gravidez, um efeito especial de ambos esses hormônios é inibir a secreção de leite. Por outro lado, o hormônio prolactina (PRL) tem o efeito exatamente oposto sobre a secreção de leite, promovendo-a. Sua concentração no sangue da mãe aumenta uniformemente a partir da quinta semana de gravidez até o nascimento do bebê, época em que já aumentou 10 a 20 vezes do nível normal não-grávido. Entretanto, ainda que os níveis de prolactina aumentem à medida que a gravidez avança, não ocorre a secreção de leite porque os estrogênios e a progesterona inibem os efeitos da prolactina. Após o parto, os níveis de estrogênios e progesterona no sangue materno diminuem e a inibição é removida.
Além disso, a placenta secreta grandes quantidades de somatomamotropina coriônica humana (HCS) ou hormônio lactogênico placentário humano (HPL), que provavelmente tem propriedades lactogênicas, apoiando, assim, a prolactina da adenohipófise materna durante a gravidez.
